|
高中化学知识点讲解《盐类水解的原理》考点预测(2019年强化版)(十)
2019-05-30 02:48:53
【 大 中 小】
|
1、填空题 直接排放含SO2,的烟气会形成胶雨,危害环境。利用钠碱循环法可脱除烟气中的SO2
(1)在钠碱循环法中,Na2 SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,
该反应的离子方程式是
(2)吸收液吸收SO2的过程中,pH随n(SO3²-):n(HSO3
参考答案:
本题解析:
本题难度:困难
2、选择题 有人曾建议用AG表示溶液的酸度,AG的定义为:AG=lg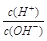 ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( ) ,室温下实验室用0.01 mol·L-1的氢氧化钠溶液滴定20 mL相同浓度的醋酸溶液,滴定曲线如右图所示。下列有关叙述正确的是( )
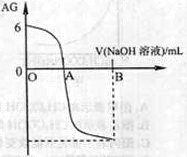
A.A点时加入氢氧化钠溶液体积为20 mL
B.室温时0.01 mol·L-1的醋酸溶液pH=4
C.OA段溶液中:c(CH3COO-)> c(CH3COOH)
D.若B点时加入NaOH溶液40 mL,所得溶液中:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+)
|
参考答案:BD
本题解析:A.A点时AG=0,则c(H+)=c(OH-).溶液显中性,由于醋酸是弱酸,二者的浓度相等,所以加入氢氧化钠溶液体积为20 mL,恰好中和,则吃剩的盐水解是溶液显碱性,所以A点时加入氢氧化钠溶液体积小于20 mL,错误;B.在开始时溶液的AG=6,c(H+)/c(OH-)=106;c(H+)·c(OH-)=10-14;则c(H+)=10-4,所以在室温时0.01 mol·L-1的醋酸溶液pH=4,正确;C.由于在A点时溶液显中性,在A之前,溶液呈酸性,在A之后溶液显碱性,所以OA段溶液中是CH3COOH和CH3COONa的混合溶液,由于酸的电离作用大于盐的水解作用,所以c(H+)>c(OH-),但是不能比较c(CH3COO-)和 c(CH3COOH)大小,因此不能确定c(CH3COO-)> c(CH3COOH),错误;D.若B点时加入NaOH溶液40 mL,则所得溶液是CH3COOH和CH3COONa的等物质的量的混合溶液。根据物料守恒可得c(Na+)="2" c(CH3COO-)+2 c(CH3COOH);根据电荷守恒可得:c(H+)+ c(Na+)=c(CH3COO-)+ c(OH-) ,第二个式子减去第一个式子,整理可得:c(CH3COO-)+2 c(CH3COOH) = c(OH-) - c(H+),正确。
考点:考查溶液的酸碱性和离子浓度的大小比较的知识。
本题难度:困难
3、填空题 (1)氯化铝水溶液呈 性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式) 。实验室在保存AlCl3溶液时,常在溶液中加少量的 ,以 (填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,(填“酸性”,“中性”或“碱性”),醋酸体积 氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-) c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因 (用离子浓度关系式表示)。
参考答案:(1)酸,AI3++3H2O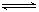 AI(OH)3+3H+ AI2O3 HCI 抑制 AI(OH)3+3H+ AI2O3 HCI 抑制
(2)碱, c(Na+)>c(CH3COO-)。(3)酸, c(Na+)<c(CH3COO-) 。
(4)中,>。(5)c(CO32-)<c(OH-),2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)
本题解析:(1)氯化铝是强酸弱碱盐,水解显酸性,方程式是AI3++3H2O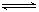 AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。 AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。
(2)醋酸和氢氧化钠的物质的量相等,恰好反应,生成醋酸钠。醋酸钠水解,溶液显碱性。所以根据电荷守恒定律可知,c(Na+)>c(CH3COO-)。
(3)由于醋酸是弱酸,所以pH=3的醋酸的浓度大于0.001mol/L,则在和氢氧化钠反应时,醋酸是过量的,所以溶液显酸性。所以根据电荷守恒定律可知,c(Na+)<c(CH3COO-)。
(4)根据电荷守恒定律可知,当溶液中醋酸根离子和钠离子浓度相等是,氢离子浓度等于OH-浓度,溶液显中性。这说明醋酸应该是过量的,所以醋酸的体积大于氢氧化钠溶液的体积。
(5)0.1 mol·L-1的NaHCO3溶液PH=9,这说明碳酸氢钠的水解程度大于碳酸氢钠的电离程度,所以溶液中c(CO32-)<c(OH-)。根据电荷守恒定律可知,离子浓度的关系是2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)。
本题难度:一般
4、填空题 (16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
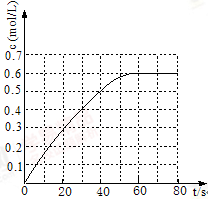
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
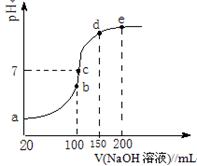
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
参考答案:(16分)(1)C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol(3分)
(2)(7分)①6.67 (3分) ②A(2分) ③< (2分)
(3)(6分)①NH4+(3分) ②c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)(3分)
本题解析:(1)根据题意可得热化学来源:91 考试网方程式:C2H8N2(l)+2N2O4(l)=2CO2(g)+3N2(g)+4H2O(l) ΔH=-2550 kJ/mol;①根据图像和题意可知,在298k时,该反应达到平衡时,c(N2O4)="0.6mol/L," c(NO2)=0.3mol/L,所以该反应的平衡常数为K= L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。 L /mol; ②A.由于反应是在恒容的密闭容器内减小的,所以在任何时刻都存在混合气体的密度保持不变,一般不能判断反应达到平衡状态,错误; B.由于容器的容积不变,若混合气体的颜色不再变化,说明物质的浓度不变,反应达到平衡状态,正确; C.该反应的气体体积减小的反应,若未达到平衡状态,则气体的压强就会发生变化,因此气压恒定时,则反应处于平衡状态,正确。故选项是A;③若反应在298K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则由于物质的浓度不变,但是该反应的正反应是放热反应,根据平衡移动原理:升高温度,平衡向吸热反应方向移动,即平衡逆向移动所以V(正)<V(逆);(3)①NH4HSO4是强酸弱碱盐,弱碱阳离子NH4+水解消耗水电离产生的OH-,使溶液显酸性,而且NH4HSO4是强酸的酸式盐,电离也产生H+,使溶液显酸性。b点时,溶液中发生水解反应的离子是NH4+;②在c点时溶液呈中性,c(OH-)=c(H+),n(Na+)=0.015mol;n(SO)=0.01mol,由于NH4+会发生水解反应而消耗,所以n(NH4+)< 0.01mol,因为溶液的体积是相同的,所以微粒的物质的量越多,离子浓度就越大,因此c(Na+)> c(SO)>c(NH),在溶液中水电离程度很小,所以c(OH-)、c(H+)都很小,远小于盐电离产生的离子浓度,因此溶液中各离子浓度由大到小的排列顺序是c(Na+)>c(SO)>c(NH)>c(OH-)=c(H+)。
考点:考查热化学方程式的书写、化学平衡状态的判断、化学平衡常数的计算、温度对化学平衡移动的影响、盐的水解、溶液中离子浓度的大小比较的知识。
本题难度:一般
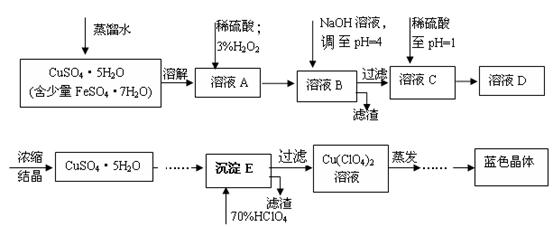
5、填空题 (本题共12分)六水合高氯酸铜 [Cu(C1O4)2 ·6H2O]是一种蓝色晶体,易溶于水,120℃时开始分解。实验室用硫酸铜的粗产品制备少量高氯酸铜晶体的流程如下:
已知:
离子
| 溶液pH值
| 开始沉淀
| 沉淀完全
| Fe2+
| 7.6
| 9.6
| Fe3+
| 2.7
| 3.7
| Cu2+
| 5.2
| 6.4
|
(1).写出A→B过程中发生反应的离子方程式为 。
(2).溶液C中加入稀硫酸调至pH=1的目的是________________________________________。
(3).如欲检验溶液C中的杂质是否除净,其操作是 。
(4).蒸发至__________(填写现象),然后经过冷却结晶、过滤、洗涤、 (填写操作),得到纯净的蓝色晶体。
(5).为了测定硫酸铜的粗产品的纯度,某同学称量硫酸铜的粗产品2.000g、 、 、(填写实验步骤)过滤、洗涤沉淀、在空气中灼烧,至质量不再改变时,称得质量为0.58816 g。
(6).该样品的纯度为___________。如果样品的实际纯度为93.2%,则测定的相对误差为__________。
参考答案:(1).2Fe2++2H++H2O2→2Fe3++2H2O (2分)
(2).防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体 (2分)
(3).取少量溶液,加入KSCN溶液(NH4SCN溶液),观察溶液是否仍然为蓝色。(2分)
(4).有晶膜出现 低温烘干(或自然干燥) (2分)
(5).加水溶解 、加入过量NaOH(aq) (共2分,各1分)
(6).91.9% -1.4%(或-1.39%) (共2分,各1分)
本题解析:(1).加入双氧水的目的是氧化亚铁离子,方程式为2Fe2++2H++H2O2→2Fe3++2H2O。
(2).由于铜离子水解显酸性,所以加入稀硫酸可防止硫酸铜溶液在蒸发浓缩过程中Cu2+发生水解而得不到纯净的晶体。
(3)如果杂质没有除净,则滤液中一定含有铁离子,所以用KSCN溶液检验即可。
(4).当蒸发有晶膜出现时,即应停止加热。洗涤之后必须烘干。
(5).要检验纯度,需要通过沉淀法将铜离子转化为氢氧化铜沉淀,所以操作是加水溶解、然后加入过量NaOH(aq)即可生成氢氧化铜沉淀。
(6)最后得到的物质是氧化铜,所以根据铜原子守恒可知,硫酸铜晶体的质量是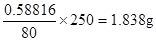 ,所以纯度是1.8385÷2×100%=91.9%,所以相对误差是(91.9%-93.2%)÷93.2%×100%=-1.4%。 ,所以纯度是1.8385÷2×100%=91.9%,所以相对误差是(91.9%-93.2%)÷93.2%×100%=-1.4%。
本题难度:困难
|