1、填空题 (12分)黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.5molSO2(g)和0.48molO2(g)放入容积为1L的密闭容器中,反应: 2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.48mol/L。则该条件下SO2的平衡转化率为 。
(2)若锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,产生的SO3与水全部化合生成H2SO4,放出26.06kJ热量,写出SO3气体转化为H2SO4的热化学方程式: 。
(3)将黄铁矿的煅烧产物Fe3O4溶于稀H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其目的是 。
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐,写出有关反应的化学方程式: 、 。
SO2既可作为生产硫酸的原料循环再利用,也可用于海水提溴过程中吸收潮湿空气中的Br2,则SO2吸收Br2的离子方程式是 。
参考答案:(1)96% (2)SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
(3)抑制Fe2+或Fe3+的水解,并防止Fe2+被氧化成Fe3+;
(4)SO2+2NH3+H2O=(NH4)2SO3、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O、SO2+Br2+2H2O=4H++2Br-+SO42-
本题解析:
(1) 2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
起始浓度(mol/L) 0.5 0.48 0
转化浓度(mol/L 0.48 0.24 0.48
平衡浓度(mol/L) 0.02 0.24 0.48
由以上所列三段式可知,SO2的平衡转化率为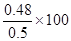 %=96%;
%=96%;
(2)锻烧12gFeS2产生的SO2全部转化为SO3气体时放出19.66kJ热量,依据硫元素守恒,n(S)=2n(FeS2)=
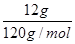 ×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
×2=0.2mol,产生的0.2mol SO3与水全部化合生成H2SO4,放出26.06kJ热量,则1mol SO3与水全部化合生成H2SO4,放出130.3kJ热量,SO3气体转化为H2SO4的热化学方程式为:SO3(g)+ H2O(l)=H2SO4(l) △H=-130.3KJ/mol;
(3)Fe3O4溶于稀H2SO4后,生成的Fe2+或Fe3+易水解,要加入稀H2SO4,抑制Fe2+或Fe3+水解;Fe2+易被氧化成Fe3+,故应加入铁粉防止氧化;
(4)从吸收塔排出的尾气中SO2先用足量氨水吸收,再用浓硫酸处理,反应的化学方程式为:SO2+2NH3+H2O=(NH4)2SO3、(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
SO2吸收Br2的离子方程式为:SO2+Br2+2H2O=4H++2Br-+SO42-
考点:考查热化学方程式的书写,化学平衡的计算应用,化学方程式离子方程式书写
点评:本题考查了热化学方程式的书写,化学平衡的计算应用,化学方程式和离子方程式书写方法,难度中等。掌握基础是解决本题的关键。
本题难度:困难
2、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液。
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
A___________________________________________________;
B____________________________________________________;
C___________________________________________________。
(2)溶液中共有______________种不同的粒子。
(3)在这些粒子中,浓度为0.01mol/L的是 ;浓度为0.002mol/L的是 。
(4) 和 两种粒子物质的量之和等于0.01mol。
参考答案:H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-(各1分,顺序可以颠倒)
CH3COOH+OH-(各1分,顺序可以颠倒)
(2)7(1分) (3)Na+(1分)Cl-(1分) (4)CH3COOH、CH3COO-(2分,顺序可以颠倒)
本题解析:(1)醋酸是弱酸,盐酸是强酸,二者混合后反应生成醋酸和氯化钠,因此存在醋酸的电离平衡。又因为醋酸钠是过量的,所以还存在醋酸根离子的水解平衡。任何水溶液中都存在水的电离平衡,有关反应的方程式分别为H2O H++OH-、CH3COOH
H++OH-、CH3COOH CH3COO-+H+、CH3COO-+H2O
CH3COO-+H+、CH3COO-+H2O CH3COOH+OH-。
CH3COOH+OH-。
(2)根据以上方程式可知,溶液中含有水分子、醋酸分子、氢离子、氢氧根离子、醋酸根离子、氯离子、钠离子,共7种微粒。
(3)已知0.01molCH3COONa,则根据离子守恒可知,浓度为0.01mol?L-1的是Na+,由0.002molHCl可知,浓度为0.002mol?L-1的是Cl-。
(4)已知0.01molCH3COONa,则根据原子守恒可知CH3COOH、CH3COO-微粒之和为0.01mol。
考点:考查离子方程式的书写;物质的量浓度的相关计算;弱电解质在水溶液中的电离平衡
本题难度:一般
3、填空题 常温下,用0.1000 mol·L-l NaOH溶液滴定20. 00mL 0.1000 mol·L-1 CH3COOH溶液所得滴定曲线如图。
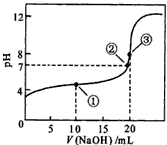
(1)反应过程中,存在电离平衡的物质的化学式为________________;
(2)在加入20. 00 mL NaOH溶液时,pH显示大于7,用离子方程式表示其原因:__________________;
(3)点①所示溶液中,各离子浓度从达到小的顺序为_____________________;
(4)点②所示溶液中,不同离子的浓度存在多种等量关系,写出其中的2种:_________、_________。
参考答案:(1)CH3COOH、H2O
(2)CH3COO-+H2O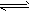 CH3COOH+OH-
CH3COOH+OH-
(3)c( CH3COO-) >c( Na+) > c(H+)> c(OH-)
(4)c( OH-) = c(H+)、c(CH3COO-)+c(OH-)=c(Na+) +c(H+)、c(CH3COO-) =c(Na+) (任意两个即可)
本题解析:
本题难度:一般
4、填空题 (10分)神舟十号飞船是中国“神舟”号系列飞船之一,它是中国第五艘搭载太空人的飞船。神舟十号飞船发射成功后,将与2011年发射升空的天宫一号目标飞行器进行交会对接,开展相关空间科学试验。火箭推进器是成功发射的重要因素,事实上,推进器的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为:S+3C+2KNO3=K2S+N2↑+3CO2↑。
①K2S的电子式为 。
②取黑火药爆炸后的残留固体,加水溶解过滤,得到滤液。写出检验此溶液中是否含有K+的实验操作方法 。
(2)20世纪60年代,火箭使用的是液体推进剂,常用的氧化剂有四氧化二氮、液氧等,可燃物有肼(N2H4)、液氢等。
①肼(N2 H4)溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式: 。
②一种与N2 H4电子数相等的绿色氧化剂,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,化学方程式为: 。
(3)以上的火箭推进剂一般含有氮元素,含氮化合物种类丰富。有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。写出其爆炸的化学方程式 。
参考答案:(每空2分,共10分)(1)① 
② 用洁净的铂丝蘸取待测液,放在火焰上灼烧,通过蓝色钴玻璃观察火焰颜色,若火焰呈紫色,则溶液中含有钾离子,反之没有。
(2)① N2H4 + H2O 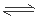 N2H5+ + OH- ②4H2O2 + PbO2 = PbSO4 + 4H2O
N2H5+ + OH- ②4H2O2 + PbO2 = PbSO4 + 4H2O
(3)2HN3 = 3N2 + H2或 H2N6 = 3N2 + H2
本题解析:(1)①K2S是离子化合物,其电子式为 ;②检验溶液中含有K+的实验操作方法是用洁净的铂丝蘸取待测液,放在火焰上灼烧,然后通过蓝色钴玻璃观察火焰颜色,若火焰呈紫色,则溶液中含有钾离子,反之没有。(2)①肼(N2 H4)溶于水显碱性,其原理与氨相似,其溶于水呈碱性的离子方程式是:N2H4 + H2O
;②检验溶液中含有K+的实验操作方法是用洁净的铂丝蘸取待测液,放在火焰上灼烧,然后通过蓝色钴玻璃观察火焰颜色,若火焰呈紫色,则溶液中含有钾离子,反之没有。(2)①肼(N2 H4)溶于水显碱性,其原理与氨相似,其溶于水呈碱性的离子方程式是:N2H4 + H2O 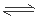 N2H5+ + OH-;②一种与N2 H4电子数相等的绿色氧化剂是H2O2,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,根据题意及电子守恒、原子守恒,可得反应的化学方程式为:4H2O2 + PbO2 = PbSO4 + 4H2O;(3)有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。n(N)=" (67." 2L÷22.4L/mol)×2=6mol,n(H)= (86g-6mol×14g/mol)÷1g/mol=2mol,所以该化合物的分子式是HN3或H2N6。其爆炸的化学方程式是2HN3 = 3N2 + H2或 H2N6 = 3N2 + H2。
N2H5+ + OH-;②一种与N2 H4电子数相等的绿色氧化剂是H2O2,能将油画表面黑色的PbS氧化成白色的PbSO4,使油画变白、翻新,根据题意及电子守恒、原子守恒,可得反应的化学方程式为:4H2O2 + PbO2 = PbSO4 + 4H2O;(3)有一含氮化合物,具有很强的爆炸性,86g该化合物爆炸分解会生成标况下N267. 2L和另一种气体单质H2。n(N)=" (67." 2L÷22.4L/mol)×2=6mol,n(H)= (86g-6mol×14g/mol)÷1g/mol=2mol,所以该化合物的分子式是HN3或H2N6。其爆炸的化学方程式是2HN3 = 3N2 + H2或 H2N6 = 3N2 + H2。
考点:考查物质的电子式的书写、物质反应的化学方程式、离子方程式的书写的知识。
本题难度:困难
5、选择题 25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-)
B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-)
C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+)
D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+)