1、选择题 下列化合物:①SO3 ②Fe(OH)3 ③FeCl2 ④CuS ⑤H2SiO3 ⑥NaHCO3其中不可能通过化合反应制得的是
[? ]
A.①②⑤⑥
B.③④⑤⑥
C.④⑤
D.①②③⑤
参考答案:C
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
A.SO2有漂白性,所以能使品红溶液、溴水、KMnO4溶液褪色
B.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,其原理相同
C.能使品红溶液褪色的不一定是SO2
D.SO2和Cl2都能漂白,若将两种气体同时通入,漂白效果会更好
参考答案:C
本题解析:A选项中,SO2使品红溶液褪色是由于其漂白性,但使溴水、KMnO4溶液褪色却是因为其还原性,将溴水、KMnO4还原。B选项中漂白粉,Na2O2褪色原理是因为氧化性,活性炭是因为吸附能力,SO2是因为与有色色素结合生成无色物质。D选项中SO2和Cl2同时漂白会相互反应生成盐酸和硫酸(SO2+Cl2+2H2O=H2SO4+2HCl),从而都丧失漂白性。
本题难度:一般
3、选择题
已知臭氧能使湿润的KI淀粉试纸变蓝,反应的方程式为KI+O3+H2O KOH+I2+O2(未配平),下列说法正确的是(?)
KOH+I2+O2(未配平),下列说法正确的是(?)
A.O3在反应中被氧化成O2
B.1 mol O3在反应中只有 mol的氧原子化合价发生了变化
mol的氧原子化合价发生了变化
C.1 mol O3在反应中得到2 mol电子
D.反应中氧化产物与还原产物的物质的量之比为2∶3
参考答案:C
本题解析:由反应方程式可知,1 mol O3在反应中只有 mol O3(即1 mol O)化合价发生了变化,得到2 mol电子。
mol O3(即1 mol O)化合价发生了变化,得到2 mol电子。
本题难度:简单
4、实验题 已知盐酸加到品红溶液中,使品红溶液的红色加深。试推测:
 (1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
(1)向品红溶液中通过量SO2的过程中的现象为__________;加热后的现象为_______。
 (2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为____________。
 (3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
(3)向品红溶液中通入物质的量比为1∶1且足量的SO2和Cl2后现象为___________。
参考答案: (1)溶液颜色先变深后又逐渐褪去?逐渐恢复原来的红色。
(1)溶液颜色先变深后又逐渐褪去?逐渐恢复原来的红色。
 (2)溶液的颜色先变深后又逐渐褪去,不再恢复红色(或仍为无色)。
(2)溶液的颜色先变深后又逐渐褪去,不再恢复红色(或仍为无色)。
 (3)溶液的红色比原来加深。
(3)溶液的红色比原来加深。

本题解析:当向品红溶液中通入过量的SO2时,发生如下反应:SO2+H2O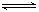 H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O
H2SO3,生成的酸能使品红溶液红色加深,因SO2过量,SO2与品红溶液结合成不稳定的无色物质而褪色,加热,无色物质分解又逐渐恢复到原来的红色。当向品红溶液中通入Cl2,因Cl2+H2O

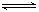 HClO+HCl同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O
HClO+HCl同样生成了酸,品红溶液红色加深,因Cl2过量,Cl2氧化有色物质而褪色,加热后不再恢复红色,当向品红溶液中通入1∶1的SO2和Cl2时,两者发生以下反应:Cl2+SO2+2H2O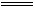 2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
2HCl+H2SO4,因生成了酸,使品红溶液颜色加深。
本题难度:一般
5、选择题 将质量分数为3x%的M溶液和质量分数为x%的M溶液等体积混合后,溶液的质量分数小于2x%,则M可能是(?)
A.H2SO4
B.氨水
C.NaOH
D.HNO3
参考答案:CD
本题解析:由前面分析可知当混合后溶液质量分数小于两者总和一半时,必然符合浓度越大,密度越小,所以应该是NaOH和乙醇。
本题难度:简单