1、选择题 下列各物质的学名是:Na2S2O3叫硫代硫酸钠;CaSx叫多硫化钙;Na2O2叫过氧化钠;KO2叫超氧化钾.试综合上述命名规律,分析回答:Na2CS3应读做
A.硫代碳酸钠?
B.多硫碳酸钠
C.过硫碳酸钠?
D.超硫碳酸钠
参考答案:A
本题解析:
本题难度:简单
2、填空题 L、M、Q、R、X代表五种物质,它们都含某种价态的氮元素,各物质中氮元素的化合价只有一种.物质L中氮元素的化合价比物质M中氮元素的化合价低.在一定条件下,它们会有如下的转化关系(未配平).
Q+HCl→M+Cl2+H2O
R+L→X+H2O
R+O2→L+H2O
请判断:
(1)五种物质按氮元素的化合价从高到低的顺序排列是______,
若五种物质中有一种是硝酸,那么硝酸应该是______(用字母表示)
(2)某同学写出下面不同价态的氮的化合物相互转化关系(未配平),其中你认为一定不能实现的是______
A.NO+HNO3→N2O3+H2OB.NH3+NO→HNO2+H2OC.N2O4+H2O→HNO3+HNO2.
参考答案:(1)根据提意已知反应以及元素化合价的变化规律,可知①反应式中,Cl2是氧化产物,M是还原产物,因此氮元素化合价:Q>M;同理由③得氮元素化合价:L>R;由②反应式可知,X中氮的化合价介于R和L之间,又由于L>R,因此L>X>R,根据已知氮元素化合价M>1,五种化合物中氮元素化合价由高到低的顺序为:Q>M>L>X>R,HNO3中N的价态最高:+5价,Q为硝酸,
故答案为:Q>M>L>X>R;Q;
(2)B不可能实现,NH3中N为-3价,NO中N为+2价,而HNO2中N为+3价,+3>+2>-3,故答案为:B.
本题解析:
本题难度:一般
3、简答题 有A、B、C、D、W五种元素.W的原子序数为29,其余的均为短周期主族元素;其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个未成对的电子;C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐;D原子核内的质子数与中子数相等,能与B形成DB2、DB3常见化合物.根据以上条件,回答下列问题:
(1)推断元素名称:A______.
(2)C元素的氢化物的空间构型为______,分子中的化学键______(填“有”或“无”)极性,其分子为______分子(填“极性”或“非极性”).
(3)比较A、B、C三种元素的第一电离能由大到小的顺序______(用元素符号表示),A、B、C三种元素的氢化物的沸点高低______(用化学式表示).
(4)写出D元素原子基态时的电子排布式______,其在元素周期表中的位置______.
(5)W元素+2价离子的水溶液呈现天蓝色,是该离子与水分子通过______键形成的______(填化学式)而显示出的颜色.
参考答案:有A、B、C、D、W五种元素.W的原子序数为29,则W为Cu元素;其余的均为短周期主族元素,C元素氢化物与其最高价氧化物对应水化物之间反应生成一种盐,则C为N元素;A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,则外围电子排布为2s22p2,则A为碳元素;B原子最外层中有两个未成对的电子,其最外层电子数不能为4,则外围电子排布为2s22p4,故B为氧元素;D原子核内的质子数与中子数相等,能与O元素形成DO2、DO3常见化合物,则D为硫元素,
(1)由上述分析可知,A为碳,故答案为:碳;
(2)C元素的氢化物为NH3,N原子成3个N-H键、含有1对孤对电子,采取SP3杂化,为三角锥型结构,N-H为极性键,分子不对称,为极性分子;
故答案为:三角锥型;有;极性;
(3)同周期自左而右第一电离能呈增大趋势,N原子2p能级有3个电子,处于半满稳定状态,电子能量降低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;常温下水为液体,沸点最高,氨气、甲烷常温下为气体,氨气分子中存在氢键,沸点比甲烷高,故沸点H2O>NH3>CH4,
故答案为:N>O>C;H2O>NH3>CH4;
(4)S元素原子核外有16个电子,基态时的电子排布式1s22s22p63s22p4,处于元素周期表中第三周期第ⅥA族,
故答案为:1s22s22p63s22p4;第三周期第ⅥA族;
(5)Cu2+与水分子通过配位键形成[Cu(H2O)4]2+而显示出的颜色,故答案为:配位键;[Cu(H2O)4]2+.
本题解析:
本题难度:简单
4、简答题 (12 分)揖选做题铱本题包括A、B 两小题,请选定其中一小题,并在相应的答题区域内作答。若多做,则按A 小题评分。
A. [物质结构与性质]
一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
①Mn2+基态的电子排布式可表示为?。
②NO3- 的空间构型是?(用文字描述)。
(2)在铜锰氧化物的催化下,CO 被氧化为CO2,HCHO 被氧化为CO2和H2O。
①根据等电子体原理,CO 分子的结构式为?。
②H2O 分子中O 原子轨道的杂化类型为?。
③1 mol CO2中含有的σ键数目为?。
(3) 向CuSO4溶液中加入过量NaOH 溶液可生成[Cu (OH)4 ]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为?。
参考答案:
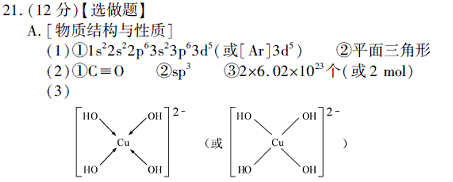
本题解析:(1)Mn原子序数为25,价电子排布为3d54s2,先失去4s上二个电子,即得Mn2+。NO3- 离子中氮原子无孤对电子,配位原子为3,则N采用sp2杂化,所以NO3- 的空间构型为平面三角形。(2)CO与N2互为等电子体,根据氮分子的结构式可以写出CO的结构式为C≡O。H2O中O原子存在两对孤对电子,配位原子为2,价电子对为4,所以O原子采用sp3杂化。二氧化碳分子内含有碳氧双键,双键中有一个为?键,一个为?键,则1molCO2中含有2mol?键。(3)Cu2+中存在空轨道,而OH-中O原子上面有孤对电子,故O与Cu之间以配位键结合。
【考点定位】电子排布式,空间构型,杂化方式,化学键的数法以及配位键的表示
本题难度:一般
5、选择题 下列叙述正确的是
[? ]
A.化合物中一定含有σ键,可能含π键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
参考答案:B
本题解析:
本题难度:简单