1、填空题 (13分)(1)A、B、D为短周期元素,请根据信息回答问题:
元素
| A
| B
| D
|
性质或结构信息
| 工业上通过分离液态空气获得其单质,单质能助燃
| 气态氢化物的水溶液显碱性
| 原子有三个电子层,简单离子在本周期中半径最小
|
①第一电离能:A?B(填“>”、“=”、“<”),基态D原子的电子排布式为?。
②B和D由共价键形成的某化合物BD在2200℃开始分解,BD的晶体类型为?。
(2)发展煤的液化技术被纳入“十二五规划”,中科院山西煤化所关于煤液化技术的高效催化剂研发项目取得积极进展。已知:煤可以先转化为一氧化碳和氢气,再在催化剂作用下合成甲醇(CH3OH),从而实现液化。
①某含铜离子的离子结构如右图所示:
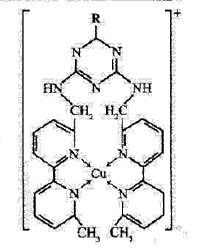
在该离子内部微粒间作用力的类型有:?(填字母)。
A.离子键? B.极性键 C.非极性键? D.配位键? E.范德华力? F.氢键
②煤液化获得甲醇,再经催化得到重要工业原料甲醛(HCHO),甲醇的沸点为65℃,甲醛的沸点为-21℃,两者均易溶于水。甲醇的沸点比甲醛高是因为甲醇分子间存在着氢键,而甲醛分子间没有氢键。甲醇和甲醛均溶于水,是因为它们均可以和水形成分子间氢键。请你说明甲醛分子间没有氢键的原因是?。
③甲醇分子中,进行sp3杂化的原子有?,甲醛与H2发生加成反应,当生成1mol甲醇时,断裂的∏键的数目为?
2、选择题 若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是( )
A.b=a-n-m
B.离子半径Am+<Bn-
C.原子半径A<B
D.A的原子序数比B大(m+n)
3、选择题 用48?mL?0.1?mol/L的FeSO4溶液,恰好还原2.4×10-3?mol[RO(OH)2]+离子,则R元素的最终价态为?
[? ]
A.+2价?
B.+3价
C.+4价?
D.+5价
4、选择题 374℃、22.1Mpa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH–,由此可知超临界水
A.显中性,pH等于7
B.表现出非极性溶剂的特性
C.显酸性,pH小于7
D.表现出极性溶剂的特性
5、选择题 下列各组数据中比值不为1:2的是
A.乙烷中C-C的键能与乙烯中C=C的键能之比
B.金刚石晶体中碳原子个数与C-C共价键个数之比
C.Al基态原子核外最外层P轨道和S轨道电子数之比
D.碳基态原子核外未成对电子数和成对电子数之比