I对;II对;有
参考答案:B
本题解析:铝是地壳中含量最高的金属元素,铜是人类最早使用的金属材料,选项A不正确;过渡元素常用作催化剂,因此选项C中有因果关系,C不正确;铁在空气中表面不能生成致密氧化膜,所以选项D不正确,答案选B。
本题难度:一般
3、填空题 CuSO4·5H2O是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。
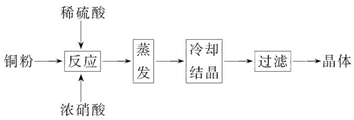
根据题意完成下列填空:
(1)向含铜粉的稀硫酸中滴加浓硝酸,在铜粉溶解时可以观察到的实验现象:_____________、_____________。
(2)如果铜粉、硫酸及硝酸都比较纯净,则制得的CuSO4·5H2O中可能存在的杂质是_____________,除去这种杂质的实验操作称为_____________。
(3)已知:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4。称取0.100 0 g提纯后的CuSO4·5H2O试样于锥形瓶中,加入0.100 0 mol/L氢氧化钠溶液28.00 mL,反应完全后,过量的氢氧化钠用
0.100 0 mol/L盐酸滴定至终点,耗用盐酸20.16 mL,则0.100 0 g该试样中含CuSO4·5H2O_____________g。
(4)上述滴定中,滴定管在注入盐酸之前,先用蒸馏水洗净,再用_____________。
参考答案:(1)铜粉溶解,溶液呈蓝色?有红棕色气体产生
(2)Cu(NO3)2?重结晶? (3)0.098 0
(4)标准盐酸润洗2~3次
本题解析:(1)铜和浓硝酸反应的化学方程式为:Cu+4HNO3(浓)=Cu(NO3)2+
2NO2↑+2H2O,其反应现象是铜逐渐溶解,溶液变蓝,产生红棕色气体。加入稀硫酸的目的是H+和Cu(NO3)2中的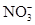 结合成HNO3,继续和铜反应,尽可能地降低溶液中 结合成HNO3,继续和铜反应,尽可能地降低溶液中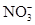 的含量,得到纯净的CuSO4。(2)CuSO4·5H2O中可能存在少量的Cu(NO3)2杂质,它和CuSO4一样都易溶于水,可以利用它们的溶解度随温度的变化程度不同,采用重结晶的方法分离提纯。(3)跟CuSO4反应的n(NaOH)=0.100 0 mol/L×(0.028 00 L-0.020 16 L)=7.84×10-4 mol,n(CuSO4)= 的含量,得到纯净的CuSO4。(2)CuSO4·5H2O中可能存在少量的Cu(NO3)2杂质,它和CuSO4一样都易溶于水,可以利用它们的溶解度随温度的变化程度不同,采用重结晶的方法分离提纯。(3)跟CuSO4反应的n(NaOH)=0.100 0 mol/L×(0.028 00 L-0.020 16 L)=7.84×10-4 mol,n(CuSO4)=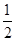 n(NaOH)=3.92× n(NaOH)=3.92×
10-4 mol,m(CuSO4·5H2O)=3.92×10-4 mol×250 g/mol=0.098 0 g。(4)滴定管在注入盐酸之前,先用蒸馏水洗净,再用标准盐酸润洗2~3次
本题难度:一般
4、计算题 钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数) 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到 气体 气体
224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的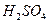 。溶液中,充分反应后,测得的实验数据如下表所示: 。溶液中,充分反应后,测得的实验数据如下表所示:
?实验序号
| ? I
| ?Ⅱ
| ?Ⅲ
| ?加入钢样粉末的质量/g
| ? 2.812
| ? 5.624
| ? 8.436
| ?生成气体的体积/L(标准状况)
| ? 1.120
| ? 2.240
| ? 2.800
|
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
参考答案:(1)解:6.62g铁矿石中铁的质量为
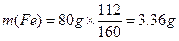
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)
答:至少需要这种铁矿石1.97t。
(2)
①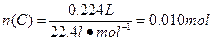 ? ?
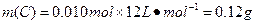
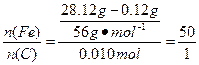
答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
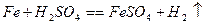
1mol? 22.4L
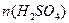 ? 2.800L ? 2.800L
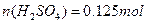

答:硫酸溶液的物质的量量浓度为
③当钢样粉末中的铁未全部溶解时( ),剩余的固体质量为: ),剩余的固体质量为:
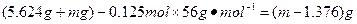
当钢样粉末中的铁全部溶解时( ), ),
剩余的固体质量为: ? ?
答:当铁未完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为
本题解析:(1)解:6.62g铁矿石中铁的质量为
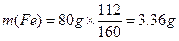
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)
答:至少需要这种铁矿石1.97t。
(2)
①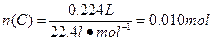 ? ?

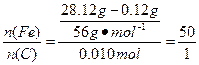
答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
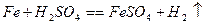
1mol? 22.4L
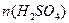 ? 2.800L ? 2.800L
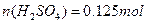

答:硫酸溶液的物质的量量浓度为
③当钢样粉末中的铁未全部溶解时( ),剩余的固体质量为: ),剩余的固体质量为:
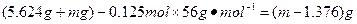
当钢样粉末中的铁全部溶解时( ), ),
剩余的固体质量为: ? ?
答:当铁未完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为 ;当铁完全溶解时,剩余固体的质量为
本题难度:一般
5、填空题 氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42—等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
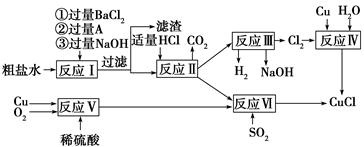
(1)A的化学式为________。
(2)写出反应Ⅴ的化学方程式______________________________________
(3)写出反应Ⅵ的离子方程式______________________________________
(4)本工艺中可以循环利用的物质是(用化学式表示)___________________________
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃?燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_________________________
参考答案:(1)Na2CO3
(2)2Cu+O2+2H2SO4=2CuSO4+2H2O
(3)2Cu2++2Cl-+SO2+2H2O=2CuCl↓+4H++SO42—
(4)NaOH、H2SO4
(5)加快乙醇和水的蒸发,防止CuCl被空气氧化
本题解析:制备过程会涉及到分离提纯的实验,要注意结合流程综合考虑。为了使杂质尽量除尽,一般加入的除杂试剂需要过量,过量的除杂试剂在后边的操作中被除去。
本题难度:一般
|