1、填空题 (12分)某兴趣小组对如何延长硫酸亚铁溶液的保质期展开了研究。
⑴制备硫酸亚铁溶液,最合适的试剂组为?▲ ?(填编号);
a.过量铁屑和稀硫酸?b.过量稀硫酸和铁屑?c.过量硫酸铁溶液和铁屑
⑵实验室保存硫酸亚铁溶液的一般方法是__________▲ ___________________;
该兴趣小组取等体积的硫酸亚铁溶液分别加入三个烧杯中,各滴入3 滴KSCN试剂,然后进行如下实验:
烧杯编号
| ①
| ②
| ③
|
加入试剂
| 铁粉0.1g
| 铁粉0.1g,0.1mol/LH2SO43mL
| 0.1mol/LH2SO43mL
|
红色出现时间(天)
| 1天
| 4天左右
| 8天以上
|
?
⑶在烧杯②中加入2种试剂后,即可观察到的现象为?▲ ?;
⑷通过比较上述3组实验,可以得出的结论为?▲ ?;
⑸硫酸亚铁溶液在空气中易氧化,氧化产物易水解生成Fe(OH)3,导致溶液酸性增大。
①?试用一个离子方程式表示上述反应过程中的变化?▲ ?;
②硫酸亚铁溶液在空气中变质的反应为可逆反应,试用化学平衡理论解释烧杯③出现红色最晚的原因?▲ ?。
参考答案:

本题解析:略
本题难度:一般
2、计算题 40克铁粉投入到500克稀HNO3中,若两种物质恰好完全溶解(还原产物为NO),求此稀HNO3的质量分数和生成气体在标态下的体积?
参考答案:(1)生成物全部是Fe(NO3)3时。
设HNO3的质量为x,生成NO的体积为V1
Fe+4HNO3====Fe(NO3)3+NO↑+2H2O
56g?4×63g?22.4L
40g?x? V1
解得:x=180g。
V1=16L。
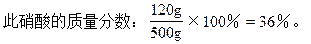
(2)当生成物全部是Fe(NO3)2时
设HNO3的质量为y,生成NO的体积为V2
3Fe? +? 8HNO3====3Fe(NO3)2+2NO↑+4H2O
3×56g?8×63g?2×22.4L
40g? y? V2
解得:y=120g,V2=10.67L,
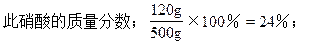
(3)当生成物是Fe(NO3)2和Fe(NO3)3时硝酸的质量分数在24%~36%之间,
生成NO气体的体积在10.67L~16L之间。
∴此硝酸的质量分数是:24%≤HNO3%≤36%,
生成NO的体积是:10.67L≤VNO≤16L。
本题解析:恰好完全溶解有3种情况:(1)生成物全部是Fe(NO3)3,(2)生成物全部是Fe(NO3)2,(3)生成物是Fe(NO3)3和Fe(NO3)2的混合物。
本题难度:一般
3、选择题 (9分)在一次化学兴趣小组活动中,一小组利用物质间互变,设计成一平面“魔方”,如图所示:
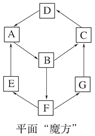
已知:①A、B、C、D、G含有同一种元素。
②有下列表格:
物质
| 纯A(单质)
| B(溶液)
| D(固体)
| G(溶液)
|
颜色
| 银白色
| 黄色
| 红棕色
| 浅绿色
|
③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;在水溶液中B也能将一种气体氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E和G。
根据以上信息填空:
(1)写出D的化学式________;G生成C的过程中所出现的现象为________________________________________________________________________。
(2)写出下列反应的化学方程式:E→A________;A→B________。
(3)B→F的离子方程式为_________________________________________________。
参考答案:(1)Fe2O3 先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(2)4H2+Fe3O4△3Fe+4H2O
2Fe+3Cl2点燃2FeCl3
(3)2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
本题解析:
答案:(1)Fe2O3 先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(2)4H2+Fe3O4△3Fe+4H2O
2Fe+3Cl2点燃2FeCl3
(3)2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
解:由题意,
物质
纯A(单质)
B(溶液)
D(固体)
G(溶液)
颜色
银白色
黄色
红棕色
浅绿色
?
Fe
FeCl3
Fe2O3
FeSO4
E是通常情况下密度最小的气体H2;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀FeCl3+3AgNO3=3AgCl+Fe(NO3)3;在水溶液中B也能将一种气体氧化物氧化为F, 2Fe3++SO2+2H2O===2Fe2++SO42-+4H+,F是含有三种元素的化合物,与A反应生成E和G,Fe+H2SO4=FeSO4+H2↑。
A―Fe,B―FeCl3,C―Fe (OH)3 ,?D―Fe2O3 ,E―H2?,F―H2SO4 ,G―Fe SO4
(1)先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
B为红棕色Fe2O3,G生成C,Fe2++2OH―="Fe" (OH)2 ,4Fe(OH)2+O2+2H2O="4Fe" (OH)3,,现象是先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色
(2) E→A 的方程式:4H2+Fe3O4△3Fe+4H2O
A→B的方程式:2Fe+3Cl2点燃2FeCl3
(3) B→F的离子方程式为:2Fe3++SO2+2H2O===2Fe2++SO42-+4H+
本题难度:一般
4、选择题 下列物质转化在给定条件下能实现的是( )
①AL2O3
NaALO2(aq)AL(OH)3
②SSO3H2SO4
③饱和NaCL(aq)NaHCO3Na2CO3
④FeFe3O4FeCL3.
A.①③
B.②③
C.②④
D.①④
参考答案:A
本题解析:
本题难度:简单
5、填空题 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = ?N a2Fe2O4+?NH3+?NaOH
a2Fe2O4+?NH3+?NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  ?Fe3O4+4NaOH
?Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为?,被还原物质是? 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:?。
参考答案:

本题解析:略
本题难度:一般