1、简答题 氯气是一种重要的化工原料,在生产和生活中应用十分广泛.在实验室可用二氧化锰固体和浓盐酸制氯气.
(1)请为该实验选择合适的发生装置______(填A或B),写出仪器①的名称______
(2)当集气瓶中收集满氯气时,可以观察到气体呈______色.尾气通常用______吸收.
(3)工业上常用电解饱和食盐水制取氯气,试写出该反应的化学方程式:______.
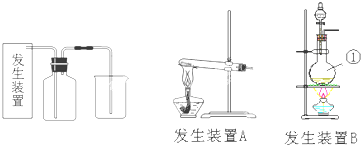
参考答案:(1)用二氧化锰固体和浓盐酸加热制取氯气,根据该反应知,反应物是固液混合的,反应条件是加热,所以该反应需要的装置是固液混合加热型装置,①仪器名称为圆底烧瓶;
故答案为:B、圆底烧瓶;
(2)氯气是黄绿色气体,是有毒的污染气体,不能排放到空气中;需要用氢氧化钠溶液吸收,故答案为:黄绿,NaOH溶液;
(3)电解饱和食盐水氯离子在阳极失电子发生氧化反应生成氯气,阴极上氢离子得到电子发生还原反应生成氢气,氢氧根离子浓度增大生成氢氧化钠;所以依据产物写出反应的化学方程式为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;故答案为:2NaCl+2H2O?电解?.?2NaOH+H2↑+Cl2↑;
本题解析:
本题难度:一般
2、简答题 实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示:
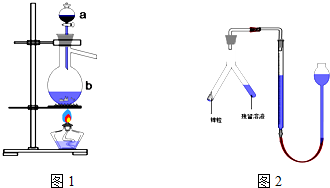
(1)图1中仪器a的名称是:______;仪器b的名称是:______;b中加入碎瓷片的作用是:______.
(2)请写出仪器b中发生的反应的离子方程式:______
(3)检查装置的气密性之后的操作依次是:______、______、______.(填序号)
A.向烧瓶中加入MnO2粉末
B.加热
C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止.为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:
①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量.
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去).使Y形管中的残留溶液与锌粒反应的正确操作是______(“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”).在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意:______.两种方案我认为______(填甲或乙)同学的方案可行.
参考答案:(1)根据实验室制取氯气的反应原理,二氧化锰与浓盐酸是在烧瓶中进行的,此处用的是蒸馏烧瓶,浓盐酸盛放在分液漏斗中,加热反应时为了防止液体的暴沸,需要加入碎石防止暴沸.
故答案为:分液漏斗;蒸馏烧瓶;防止液体暴沸
(2)实验室制取氯气是利用二氧化锰将浓盐酸中的HCl氧化得到的,故反应的离子方式为:MnO2+4H++2Cl-△.Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl-△.Mn2++2H2O+Cl2↑.
(3)因为氯化氢气体有毒,如果先加入浓盐酸再加入二氧化锰,会有气体挥发出来污染大气,因此先加二氧化锰,再加浓盐酸,然后加热.
故答案为:A、C、B
(4)为了使测得的盐酸浓度,需要准确的测出氢气的量,如果先加锌粒再加盐酸,则马上有气体产生,从而是产生的气体有损失,使测得的气体的量不准确,测得的盐酸的浓度不准,因此应将锌粒转移至残留溶液中;压强对气体的体积有影响该反应是在加热条件下进行的,温度升高气体压强增大,如果不回复到原温度,相当于将气体压缩了,使得测出的气体的体积减小.故温度要恢复到原温度时,同时上下移动右端的漏斗,使两端的液面的高度相同,视线要与液体的凹液面相切,读取测量气体的体积.
故答案为:恢复至室温;乙
本题解析:
本题难度:一般
3、简答题 如图1是某研究性学习小组利用实验室制氯气的装置设计制取氯水并进行相关实验.

(1)A装置中发生化学反应的离子方程式为______.
(2)氯气能使湿润的红色布条褪色.对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能.请你设计实验,得出正确结论.
①提出假设假设一______.假设二______.假设三______.假设四H2O使布条褪色
②设计实验方案
基于提出的假设,设计出实验方案(不需要作答)
③实验过程
实验①:______;实验②:______.实验③:把红色布条放在水里,布条不褪色.
④得出结论______.
(3)用量筒取20mL氯水,倒入已检查完好的分液漏斗中,然后再注入10mLCCl4,盖好玻璃塞,振荡,静置于铁架台上(如图2),等分层后取上层液和下层液,呈黄绿色的是______(填“上层液”或“下液”),再装入如图3所示的烧杯中,能使有色布条褪色的是______(填“上层液”或“下层液”)
(4)上述制备并吸收氯气装置的缺点是______,如何改进______,在图4框中画出改进的实验装置图______.
参考答案:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、水和氯气,氧化物、气体、弱电解质写化学式,可溶性的强电解质写离子式,反应的离子方程式为:MnO2+4H++2C1-△.Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2C1-△.Mn2++Cl2↑+2H2O;
(2)①氯水中含有氯气、盐酸、水和次氯酸,可分别根据这四种物质进行实验设计,提出假设假设一:盐酸能使红色布条退色;假设二:氯气使红色布条退色;假设三:HClO能使布条退色;假设四 H2O使布条褪色,
故答案为:盐酸能使红色布条退色;氯气使红色布条退色;HClO能使布条退色;
③实验①:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;实验②:用把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;实验③:把红色布条放在水里,布条不褪色,
故答案为:用玻璃棒蘸取稀盐酸滴到红色布条上,红色布条不退色,说明盐酸没有漂白作用;把干燥的红色布条放入充满氯气的集气瓶中,红色布条不退色,说明氯气没有漂白作用;
④次氯酸具有强氧化性和漂白性,可使红色布条褪色,
故答案为:次氯酸使红色布条退色;
(3)氯气易溶于四氯化碳,四氯化碳密度大于水的密度,所以呈黄绿色的为下层液;由于氯气能够使有色布条褪色,上层液中有次氯酸,所以使有色布条褪色的是上层液,
故答案为:下层液;上层液;
(4)氯气不能直接排放到空气中,应加入尾气处理装置,因氯气可与氢氧化钠反应,则尾气处理装置用氢氧化钠溶液,改进的实验装置图为: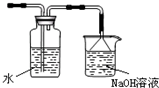 ,
,
故答案为:会造成环境污染;增加尾气吸收装置; .
.
本题解析:
本题难度:一般
4、选择题 实验室制氯气时有如下操作,操作顺序排列正确的是
[? ]
①连接好装置,检查装置的气密性②缓缓加热③在烧瓶中加入少量的MnO2,分液漏斗中加入浓盐酸④从分液漏斗中慢慢向烧瓶中注入浓盐酸⑤将多余氯气用NaOH溶液吸收⑥用向上排气法收集氯气
A.①②③④⑤⑥
B.③④②①⑥⑤
C.①④③②⑥⑤
D.①③④②⑥⑤
参考答案:D
本题解析:
本题难度:简单
5、选择题 某同学用下列装置制备并检验Cl2的性质。下列说法错误的是( ? )
A.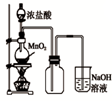
如图中:即使MnO2过量,盐酸也不能全部消耗
B.
如图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
C.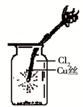
如图中:生成棕色的烟
D.
如图中:水可以充满试管
参考答案:D
本题解析:
本题难度:一般