1、选择题 下列哪组元素的原子间反应易形成离子键
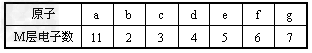
[? ]
A.a和c?
B.a和f?
C.d和g?
D.b和g
参考答案:BD
本题解析:
本题难度:简单
2、选择题 下列化学用语正确的是
[? ]
A .I-131:7853I
B.Cl的结构示意图: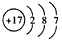
C.H2S的电子式: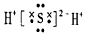
D.Fe3+的电子排布图:1s22s22p63s23p63d5
参考答案:B
本题解析:
本题难度:简单
3、填空题 下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族
周期 | IA | | 0
1
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
①
②
③
3
④
⑤
⑥
⑦
⑧
4
⑨
|
(1)写出⑧的原子核外电子排布式______?写出⑤的离子核外电子排布式______
(2)在这些元素中,化学性质最不活泼的是:______(填具体元素符号,下同)
(3)在最高价氧化物的水化物中,酸性最强的化合物的分子式是______,碱性最强的化合物的电子式是:______;
(4)用电子式表示元素④和⑥的化合物的形成过程:______,此化合物属于______(填“共价”或者“离子”)化合物.
(5)表示①与③的化合物的电子式______,该化合物的共价键类型是______
(6)由③和④按原子个数比1:1形成的化合物的电子式是______;该化合物的化学键类型是______.
参考答案:,①为C元素,②为N元素,③为O元素,④为Na元素,⑤为Al元素,⑥为S元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,则
(1)⑧为Ar元素,原子序数为18,电子排布式为1s22s22p63s23p6,⑤为Al元素,离子核外有10电子,电子排布式为1s22s22p6,故答案为:1s22s22p63s23p6;1s22s22p6;
(2)在这些元素中,Ar原子最外层电子数为8,处于稳定结构,性质稳定,为最不活泼元素,故答案为:Ar;
(3)元素的非金属性最强的是Cl元素,对应的最高价氧化物的水化物HClO4酸性最强,金属性最强的是为K,对应的最高价氧化物的水化物KOH的碱性最强,电子式为
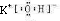
,故答案为:HClO4;
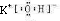
;
(4)元素④和⑥的化合物为Na2S,为离子化合物,含有离子键,用电子可表示形成过程为

,故答案为:

;离子;
(5)①与③的化合物为CO2,为共价化合物,分子中含有极性共价键,电子式为

,
故答案为:

;极性共价键;
(6)③和④按原子个数比1:1形成的化合物为Na2O2,为离子化合物,含有离子键和共价键,电子式为

,
故答案为:

;离子键和共价键.
本题解析:
本题难度:一般
4、简答题 写出下列物质或微粒的电子式
①H______Na+______?Cl-______
②H2O______?HCl______MgCl2______.
参考答案:①原子的电子式的书写由于中性原子既没有得电子,也没有失电子,所以书写电子式时应把原子的最外层电子全部排列在元素符号周围.排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过2个电子.故答案为
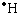
金属阳离子的电子式:金属原子在形成阳离子时,最外层电子已经失去,但电子式仅画出最外层电子,所以在画阳离子的电子式时,就不再画出原最外层电子,但离子所带的电荷数应在元素符号右上角标出.所以金属阳离子的电子式即为离子符号.
故答案为Na+
简单阴离子电子式的书写:一般非金属原子在形成阴离子时,得到电子,使最外层达到稳定结构,这些电子都应画出,并将符号用“[]”括上,右上角标出所带的电荷数,电荷的表示方法同于离子符号.
故答案为
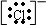
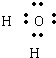
②共价化合物的电子式书写共价化合物是原子间通过共用电子对结合而成的.书写时将共用电子对画在两原子之间,每个原子的未成对电子和孤对电子也应画出.因不同元素原子吸引电子能力不同,则共用电子对偏向吸引电子能力强的原子,而偏离吸引电子能力弱的原子.
故答案为
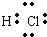
离子化合物的电子式书写:
先根据离子电子式的书写方法,分别画出阴、阳离子的电子式,然后让阴、阳离子间隔排列,注意相同离子不能合并
故答案为
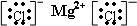
本题解析:
本题难度:一般
5、选择题 极性最强的键是(?)
A.H—S
B.H—Cl
C.H—Br
D.H—Se
参考答案:B
本题解析:在四种非金属中氯元素的非金属性最强,所以H-Cl的极性最强。
本题难度:简单