|
高中化学必备知识点《弱电解质电离平衡》考点特训(2019年冲刺版)(四)
2019-05-30 03:04:42
【 大 中 小】
|
1、选择题 下列物质:①氨水 ②醋酸 ③碳酸钙 ④氢氧化钾 ⑤酒精 ⑥Na
属于强电解质的是
A.①②③④⑤⑥
B.①④⑤
C.②③④⑤
D.③④
|
参考答案:D
本题解析:电解质是在水溶液里或熔融状态下能导电的化合物,非电解质是在水溶液里和熔融状态下都不能导电的化合物,强电解质是指在水溶液里全部电离成离子的电解质。强酸、强碱和大部分盐类都是强电解质。①氨水是混合物,既不是电解质也不是非电解质;②醋酸是混合物,既不是电解质也不是非电解质;③碳酸钙是盐,属于强电解质;④氢氧化钾是强碱,属于强电解质;⑤酒精是有机物,属于非电解质;⑥Na是单质,既不是电解质也不是非电解质;答案选D。
考点:考查电解质的分类。
本题难度:一般
2、选择题 关于小苏打水溶液的表述正确的是
[? ]
A.c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
B.c(Na+)+c(H+) =c(HCO3-)+c(CO32-)+c(OH-)
C.HCO3-的电离程度大于HCO3-的水解程度
D.存在的电离有:NaHCO3=Na++HCO3- HCO3-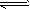 H++CO32- H2O H++CO32- H2O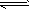 H++OH- H++OH-
参考答案:D
本题解析:
本题难度:一般
3、选择题 已知0.1mol/L的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是 CH3COO-+H+?要使溶液中c(H+)/c(CH3COOH)比值增大,可以采取的措施是
[? ]
A.加少量CH3COONH4固体?
B.降低温度?
C.加少量NaCl固体?
D.升高温度
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列事实能说明CH3COOH为弱酸的是( )
A.等浓度的HCl、CH3COOH导电能力HCl强于CH3COOH
B.浓度和体积均相等的H2SO4和CH3COOH消耗NaOH的量,H2SO4大于CH3COOH
C.1mol/L的CH3COOH溶液中H+浓度小于1mol/L
D.CH3COOH易挥发
参考答案:AC
本题解析:
本题难度:一般
5、实验题 某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol·L-1的醋酸溶液,用0.2 mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol·L-1醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、?和?。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol·L-1的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号
| 1
| 2
| 3
| 4
| 消耗NaOH溶液的体积(mL)
| 20.05
| 20.00
| 18.80
| 19.95
|
?
则该醋酸溶液的准确浓度为?(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
醋酸浓度(mol·L-1)
| 0.001 0
| 0.010 0
| 0.020 0
| 0.100 0
| 0.200 0
| pH
| 3.88
| 3.38
| 3.23
| 2.88
| 2.73
|
?
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:?。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将?(填“增大”“减小”或“不变”)。
实验三:探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
?。
参考答案:实验一
(1)胶头滴管 250 mL容量瓶
(2)0.200 0 mol·L-1
实验二
(1)0.010 0 mol·L-1醋酸的pH大于2或醋酸稀释10倍时,pH的变化值小于1
(2)增大
实验三
用pH计(或pH试纸)测定相同浓度的醋酸在几种不同温度时的pH
本题解析:实验一:(1)还缺少配制溶液所需的容器250 mL的容量瓶和定容仪器胶头滴管。
(2)首先分析NaOH的体积,第3次数据显然误差较大,舍去。另外三次所用NaOH平均体积为20.00 mL,代入计算可知醋酸的浓度为0.200 0 mol·L-1。
实验二:(1)孤立的看每次测量值,H+浓度远小于醋酸的浓度,说明醋酸不完全电离;联系起来看,浓度为0.100 0 mol·L-1、0.010 0 mol·L-1及0.001 0 mol·L-1的醋酸,pH变化值小于1。
(2)以0.100 0 mol·L-1、0.010 0 mol·L-1醋酸为例,设0.100 0 mol/L的醋酸溶液体积为1 L,将其稀释至0.010 0 mol/L,体积变为10 L,两溶液中H+的物质的量分别为:10-2.88 mol、10×10-3.38 mol,可见溶液变稀,电离出的H+的物质的量增加,故说明醋酸的电离程度增大。
实验三:探究温度对醋酸的电离程度的影响,应控制其他条件相同,只有温度存在差异的醋酸溶液H+浓度有差异,能够对溶液中H+浓度区分度较好的仪器是pH计。
本题难度:一般
|