1、选择题 在相同温度下,100mL?0.01mol/L醋酸与10mL?0.1mol/L醋酸相比,下列数值前者大于后者的是( )
A.中和时所需NaOH的量
B.电离程度
C.H+浓度
D.醋酸的物质的量
2、简答题 下列化合物:①HCl?②NaOH?③CH3COOH?④NH3?H2O?⑤CH3COONa?⑥NH4Cl
(1)属于弱电解质的是______,溶液呈碱性的有______(填序号).
(2)常温下0.01mol/L?HCl溶液的PH=______;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=______.
(3)用离子方程式表示CH3COONa溶液呈碱性的原因______,其溶液中离子浓度按由大到小的顺序为______.
(4)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m______n?(填“大于、等于、小于”).
(5)常温下,向100mL?0.01mol?L-1HA溶液逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为______酸(填“强”或“弱”).
②K点对应的溶液中,c(M+)+c(MOH)=______mol?L-1.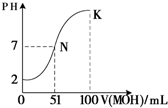
3、选择题 下列实验能达到预期目的的是?(?)
(3)常温下,向10 mL 0.01 mol·L-1H2C2O4溶液中滴加0.01 mol·L-1的KOH溶液V mL,回答下列问题:
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。