| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《离子共存》考点特训(2019年冲刺版)(十)
参考答案:B 本题解析:Fe3+与SCN-因生成Fe(SCN)3而不能大量共存,A错误;加入铝粉能产生H2的溶液可能是酸性溶液,也可能是碱性溶液,酸性条件下Fe2+与 本题难度:一般 2、选择题 在由水电离出的c(H+)=1×10-13 mol·L-1的溶液中一定大量共存的离子组是 |
参考答案:B
本题解析:离子间如果发生化学反应,则不能大量共存,反之是可以的。由水电离出的c(H+)=1×10-13 mol·L-1的溶液中水的电离是被抑制的,因此溶液可能显酸性,也可能显碱性。如果显碱性,则A中的Fe2+、C中的NH4+、D中的Mg2+均不能大量共存;如果显酸性,则C中的SO32-、D中的AlO2-均不能大量共存;又因为在酸性条件下NO3-具有强氧化性,能氧化Fe2+,所以A中的Fe2+和NO3-不能大量共存,答案选B。
考点:考查离子共存的正误判断
本题难度:一般
3、选择题 下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是( )
A.K+、Na+、Br-、SiO32-
B.H+、Fe2+、SO42-、Cl2
C.K+、Ba2+、Cl-、NO3-
D.K+、Ag+、NH3?H2O、NO3-
参考答案:A.该组离子之间不反应,能共存,但通入CO2后生成硅酸沉淀,不能共存,故A不选;
B.Fe2+、Cl2发生氧化还原反应,则不能共存,故B不选;
C.该组离子之间不反应,能共存,且通入CO2后仍能大量共存,故C正确;
D.因Ag+、NH3?H2O发生反应,则不能共存,故D错误;
故选C.
本题解析:
本题难度:简单
4、选择题 已知Ag2SO4的KW为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如下图(饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1)。若t1时刻在上述体系中加入100 mL. 0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是(?)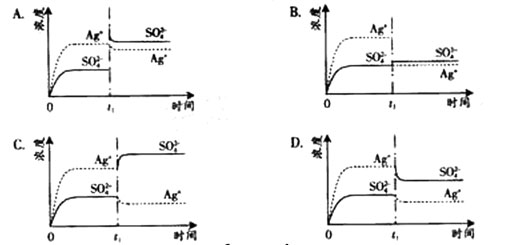
参考答案:B
本题解析:Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol/L,所以c(SO42-)=0.017mol/L;当加入100ml 0.020mol/LNa2SO4溶液后,c(SO42-)=0.0185mol/L,c(Ag+)=0.017mol/L(此时Q<Ksp)。由计算可知选B。
本题难度:一般
5、选择题 某溶液中存在较多的OHˉ、Clˉ、Na+,该溶液中还可能大量存在的离子是( )
A.Ba2+
B.Mg2+
C.HCO3ˉ
D.NH4+
参考答案:A.因溶液中的离子不与Ba2+反应,则能够大量共存,故A正确;
B.因Mg2+与OHˉ结合生成沉淀,则不能共存,故B错误;
C.因HCO3ˉ与OHˉ结合生成水和碳酸根离子,则不能共存,故C错误;
D.因NH4+与OHˉ结合生成弱电解质,则不能共存,故D错误;
故选A.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《复合材料》.. | |