1、选择题 25℃时,下列关于饱和氯水的叙述中错误的是( )
A.在饱和氯水中加入CaCO3,溶液的pH变大
B.在饱和氯水中通入SO2气体,溶液的pH变小
C.在饱和氯水中通入H2S气体,溶液的pH变小
D.在饱和氯水中加入NaOH使pH=7,所得溶液中离子浓度的关系如下:c(Na+)>c(ClO-)>c(Cl-)>c(HClO)
参考答案:A.在饱和氯水中加入CaCO3,与H+反应,则溶液酸性减弱,pH变大,故A正确;
B.在饱和氯水中通入SO2气体,与Cl2反应生成硫酸和盐酸,酸性增强,pH变小,故B正确;
C.在饱和氯水中通入H2S气体,与Cl2反应生成S和盐酸,酸性增强,pH变小,故C正确;
D.在饱和氯水中加入NaOH使pH=7,c(H+)=c(0H-),由电荷守恒可知,c(Na+)=c(ClO-)+c(Cl-),反应后溶质为NaCl、NaClO、HClO,由Cl2+H2O?HClO+HCl可知,c(Cl-)=c(ClO-)+c(HClO),则离子浓度大小为c(Na+)>c(Cl-)>c(ClO-)>c(HClO),故D错误;
故选D.
本题解析:
本题难度:一般
2、选择题 一定物质的量的Cl2与NaOH溶液反应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为(?)
A.8∶11
B.3∶5
C.1∶2
D.18∶8
参考答案:C
本题解析:根据所得产物中含NaClO和NaClO3物质的量之比为3∶5,氯原子共8个,钠离子个8个,所以氯气的物质的量是氢氧化钠的一半,答案选C。
本题难度:一般
3、选择题 在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是?
[? ]
A.向氯水中加入有色布条一会儿有色布条褪色,说明溶液中有Cl2存在
B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在
C.先加入盐酸酸化再加入AgNO3溶液产生白色沉淀,说明溶液中有Cl-存在
D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
参考答案:B
本题解析:
本题难度:简单
4、选择题 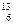 C-NMR(核磁共振)可用于含碳化合物的结构分析。有关
C-NMR(核磁共振)可用于含碳化合物的结构分析。有关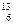 C的说法正确的是
C的说法正确的是
A.质子数为6? B.电子数为13? C.中子数为6? D.质量数为6
卤族元素按F、Cl、Br、I的顺序,下列叙述正确的是
A.单质的颜色逐渐加深? B.气态氢化物的稳定性逐渐增强
C.与氢气反应越来越容易 ?D.单质的熔、沸点逐渐降低
参考答案:A
本题解析:略
本题难度:简单
5、选择题 在1981年才第一次制得卤族元素的第五个成员砹,根据卤素性质的变化规律,我们可以预料到砹有下列性质:
(1)砹在室温下的状态是?体,颜色比碘?,它夺电子能力比碘?,?(填“有”或“没有”)挥发性,并?(填“溶”或“不溶”)于四氯化碳。
(2)AgAt的颜色比AgI?,?溶于水,HAt的稳定性比HI?。
(3)单质砹是卤素中?的氧化剂,而砹离子是卤族中?的还原剂。(填“最强”或“最弱”)
参考答案:(1)固深弱没有溶
(2)深难差
(3)最弱最强
本题解析:本题是利用卤素性质的递变规律解决实际问题。
由于卤素单质从氟到碘(或到砹)熔沸点逐渐升高,状态从气态递变到固态,颜色逐渐加深,所以砹单质在常温下为固体,难挥发,颜色比碘深,易溶于CCl4。
卤素化合物中,银盐的颜色逐渐加深,且除氟化银外都难溶于水;卤素的氢化物稳定性逐渐减弱。所以,AgAt的颜色比AgI深,难溶于水,HAt的稳定性比HI差。
从原子结构分析,砹原子在卤素中半径最大,得电子能力最弱,是卤素中最弱的氧化剂。与此相比,砹离子的还原性应当是最强的。
本题难度:简单