1、选择题 CuSO4是一种重要的化工原料,其有关制备途径及性质如图所示。下列说法不正确的是
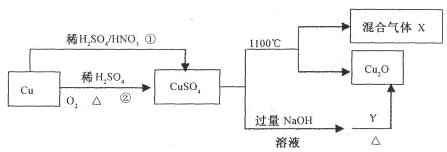
A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1 mol
D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:2
参考答案:C
本题解析:A.发生反应:3Cu+8HNO3(稀)=2Cu(NO3)2+2NO↑+4H2O,会产生大气污染物NO,而第二种方案的反应为2Cu+O2 2CuO. CuO+ H2SO4=CuSO4+H2O。不会产生污染环境的物质。因此途径②更好地体现了绿色化学思想。正确。B.向CuSO4溶液中加入过量的NaOH溶液会产生Cu(OH)2悬浊液,然后再加入含有醛基的物质如葡萄糖、甲醛、甲酸等并加热煮沸,就会发生氧化还原反应得到砖红色的Cu2O沉淀。因此Y可以是葡萄糖溶液。正确。C. n(CuSO4)=16g÷160g/mol=0.1mol.根据物质在反应时的关系可知n(H2SO4)=0.1mol.但是硫酸发生的不是氧化还原反应。错误。D.途径①反应的两种方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO3-消耗2mol的硝酸,它同时提供2mol的H+。则8mol的H+中硫酸电离产生的H+的物质的量为6mol。因此小于消耗硫酸3mol。故n(H2SO4):n(HNO3)=3:2.正确。
2CuO. CuO+ H2SO4=CuSO4+H2O。不会产生污染环境的物质。因此途径②更好地体现了绿色化学思想。正确。B.向CuSO4溶液中加入过量的NaOH溶液会产生Cu(OH)2悬浊液,然后再加入含有醛基的物质如葡萄糖、甲醛、甲酸等并加热煮沸,就会发生氧化还原反应得到砖红色的Cu2O沉淀。因此Y可以是葡萄糖溶液。正确。C. n(CuSO4)=16g÷160g/mol=0.1mol.根据物质在反应时的关系可知n(H2SO4)=0.1mol.但是硫酸发生的不是氧化还原反应。错误。D.途径①反应的两种方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,产生2mol的NO3-消耗2mol的硝酸,它同时提供2mol的H+。则8mol的H+中硫酸电离产生的H+的物质的量为6mol。因此小于消耗硫酸3mol。故n(H2SO4):n(HNO3)=3:2.正确。
本题难度:一般
2、选择题 汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑。则列判断正确的是
A.反应中KNO3为还原剂
B.NaN3中氮元素为-3价
C.标准状况下,若有6.5gNaN3参加反应,则生成3.584L N2
D.若1mol KNO,参加反应,转移电子的物质的量为10mol
参考答案:C
本题解析:A、根据方程式可知硝酸钾中氮元素的化合价从+5价降低到0价得到电子,因此硝酸钾是氧化剂,A不正确;B、钠在化合物中显+1价,因此氮化钠中氮元素的化合价是-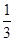 价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
价,B不正确;C、6.5g氮化钠的物质的量是6.5g÷65g/mool=0.1mol,根据方程式可知反应中生成氮气的物质的量是0.16mol,则标准状况下氮气的体积是0.16mol×22.4L/mol=3.584L,C正确;D、硝酸钾中氮元素的化合价+5价降低0价,得到5个电子,因此若1mol KNO,参加反应,转移电子的物质的量为5mol,D不正确,答案选C。
本题难度:一般
3、选择题 小明做实验时不小心粘了一些高锰酸钾,皮肤上出现了难看的黑斑,老师告诉他可以用草酸的稀溶液进行清洗,其反应的离子方程式为:
MnO4—+H2C2O4+H+—— CO2↑+Mn2++ (未配平),下列说法中正确的是 (填字母)。?
A.该反应的氧化剂为H2C2O4
B.该反应右边横线上的产物为OH-
C.该反应配平后H+的化学计量数为6
D.在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA
参考答案:C
本题解析:反应物中有H+和氧元素,则生成物中有H2O,最后一个横线上填H2O,B错;配平离子方程式:2MnO4—+5H2C2O4+6H+ 10CO2↑+2Mn2++8H2O,则1 mol H2C2O4参加反应,转移电子总数为2NA,D错;MnO4—为氧化剂,A错。
10CO2↑+2Mn2++8H2O,则1 mol H2C2O4参加反应,转移电子总数为2NA,D错;MnO4—为氧化剂,A错。
本题难度:一般
4、填空题 (12分)铬化学丰富多彩,由于铬光泽度好,常将铬镀在其他金属表面,同铁、镍组成各种性能的不锈钢。K2Cr2O7和CrO3大量用于鞣革、印染、颜料、电镀等工业中,是工业上造成铬污染的主要原因。近期暴光的“毒胶囊”事件中,就是因为用工业皮革的下脚料或破皮鞋等为原料制成的工业明胶被冒充成食用明胶制成胶囊,造成胶囊内的铬严重超标。
(1)CrO3的热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。?
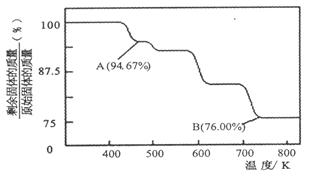
①A 点时剩余固体的成分是??(填化学式)。
②从开始加热到 750K 时总反应方程式为?。
(2)Cr(Ⅵ)主要以CrO42-和Cr2O72-形态存在,在酸性条件下具有很强的氧化性,它们在溶液中存在如下转化:CrO42-(黄色)+2H+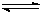 ?Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是?。
?Cr2O72-(橙色)+H2O;K=4.2×1014。若要使溶液由黄色变橙色,则应采取的措施是?。
A.加NaOH
B.加盐酸
C.加硫酸
D.加AgNO3