1、填空题 Ⅰ.2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。汽车尾气净化的主要原理为:2NO(g)+2CO(g)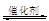 2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
2CO2(g) +N2(g),在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如下图所示。
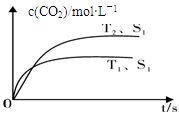
据此判断:
(1)该反应的ΔH?0(选填“>”、“<”)。
(2)若在一定温度下,将1.0 mol NO、0.5 mol CO充入0.5 L固定容积的容器中,达到平衡时NO、CO、CO2、N2物质的量分别为:0.8 mol、0.3 mol、0.2 mol、0.1 mol,该反应的化学平衡常数为K=?;若保持温度不变,再向容器中充入CO、N2各0.3 mol,平衡将?移动(选填“向左”、“向右”或“不”)。
Ⅱ.以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,下图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。
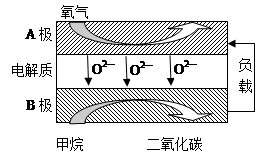
回答下列问题:
(1)B极为电池?极,电极反应式为?。
(2)若用该燃料电池做电源,用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为?(标况下)。
Ⅲ.FeS饱和溶液中存在:FeS(s) Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?。
Fe2+(aq)+S2-(aq),Ksp=c(Fe2+)·c(S2-),常温下Ksp=1.0×10-16。又知FeS饱和溶液中c(H+)与c(S2-)之间存在以下限量关系:[c(H+)]2·c(S2-)=1.0×10-22,为了使溶液中c(Fe2+)达到1 mol/L,现将适量FeS投入其饱和溶液中,应调节溶液中的pH为?。
参考答案:I.(1)<(2分)
(2)k=" 5/144" 或0.0347?(2分)?不(2分)
II.(1)负(2分)? CH4 + 4O2——8e—= CO2+ 2H2O;(2分)?
(2) 1.12 L(2分,没有写单位得1分)?
III.3 (3分)
本题解析:I.(1)结合图像分析,T1时先到达平衡,平衡时二氧化碳的浓度小,说明升高温度平衡左移,所以正反应为放热反应,ΔH<0;(2)化学平衡常数=生成物浓度的系数次方/反应物浓度的系数次方,所以k=" 5/144" 或0.0347;再向容器中充入CO、N2各0.3 mol时,Qc=k,平衡不移动。II.(1)燃料电池中负极通燃料,发生氧化反应,正极通氧气,发生还原反应。所以负极上甲烷失去电子结合氧离子形成二氧化碳和水,正极上氧气得到电子形成氧负离子。(2)用石墨做电极电解100 mL 1 mol/L的硫酸铜溶液时,阳极电极反应为:4OH——4e—= O2 + 2H2O;阴极先是:Cu2++2e— = Cu,然后是:2H++2e—= H2,设生成氧气amol,根据电子守恒可得:4a="0.1×2+2a," a=0.1mol。1molCH4转移电子8mol,所以消耗甲烷0.05mol;III.根据题目所给信息,c(Fe2+)达到1 mol/L时,c(S2-)= 1.0×10-16,因为[c(H+)]2·c(S2-)=1.0×10-22,所以c(H+)= 1.0×10-3,pH=3。
本题难度:困难
2、选择题 离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X- +3S2- +14H+==2M3+ +3S? +7H2O,
则M2O7X-中M的化合价为?(?)
A.+4
B.+5
C.+6
D.+7
参考答案:C
本题解析:S从-2到0,共失去6mol电子,每个M得到三个电子,故M2O7X-中M为+6价。
本题难度:一般
3、选择题 Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的体积相等时,实际参加反应的Cu2S与HNO3的物质的量之比为?(? )
A.1∶7
B.1∶5
C.1∶9
D.2∶9
参考答案:A
本题解析:根据NO2和NO的体积相等时,其方程式中的系数相等,根据得失电子守恒,可推出该反应的方程式为2Cu2S+14HNO3 = 2Cu(NO3)2+2CuSO4+5NO2↑+5NO↑+7H2O,所以实际参加反应的Cu2S与HNO3的物质的量之比为1∶7,故选A。
点评:本题考查氧化还原反应的内容,有一定难度,解答本题的关键是结合题意,根据反应中各个元素的化合价升降,推断得失电子情况,根据电子守恒,原子守恒,进一步推断出反应的方程式。
本题难度:一般
4、填空题 (16分)四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为TiO2 、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的
、FeO、Fe2O3,Ti的最高化合价为+4)作原料,生产白色颜料二氧化钛的 主要步骤如下:
主要步骤如下:
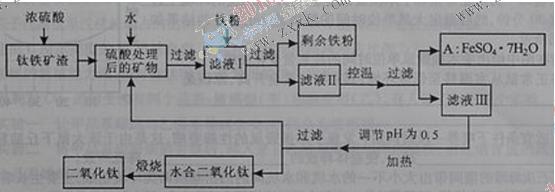
请回答下列问题:
(1)?硫酸与二氧化钛反应的化学方程式是____________________________________。
(2)?向滤液I中加入铁粉,发生反应的离子方程式为:_________________________、_______________________________________。
(3)在实际生产过程中,向沸水中加入滤液Ⅲ,使混合液pH达0.5,钛盐开始水解。水解过程中不断通入高温水蒸气,维持溶液沸腾一段时间,钛盐充分水解析出水合二氧化钛沉淀。请用所学化学平衡原理分析通入高温水蒸气的作用:_______________________________________________。
过滤分离出水合二氧化钛沉淀后,将滤液返回的主要目的是充分利用滤液中的钛盐、___________、______________、_______________________(填化学式),减少废物排放。
(4)A可用于生产红色颜料(Fe2O3),其方法是:将556a kg A(摩尔质量为278 g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐 色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
色胶体中加入3336b kg A和112c kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料_______________________kg。
参考答案:
(1) 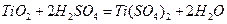 或
或
(2)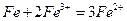 ?
?
(3) 加水促进钛盐水解,加热促进钛盐水解,降低 浓度促进钛盐水解
浓度促进钛盐水解
 ?
? ?
?
(4) 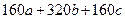
本题解析:略
本题难度:简单
5、选择题 Fe与稀HNO3反应时,若两者消耗物质的量之比为4∶10,且生成 Fe(NO3)2,则反应中生成的还原产物可能是(?)
A.N2
B.N2O
C.NO
D.NH4NO3
参考答案:BD
本题解析:硝酸与金属反应时硝酸部分被还原,假设Fe有4mol,则未被还原的硝酸为8mol,因此被还原的硝酸有2mol,4molFe在反应中失去8mol电子,所以2mol硝酸得8mol电子,这其中可以是2mol硝酸均得电子,也可以是1mol硝酸得1mol硝酸不得,因此硝酸的还原产物可能为N2O,也可能是NH4NO3。答案选BD。
点评:本题的关键就是要分析出得电子后的平均化合价,否则会漏选。
本题难度:一般