1、填空题 解决问题时,要不断加强提炼和归纳,从个别事实中找出一般的、本质的东西。离子方程式的书写中遵循“少数服从多数的思想”。判断下列离子方程式书写有无错误,有错误的指出错因并改正。
(1)碳酸钙与硝酸反应:CO32- +2H+=CO2↑+H2O
__________________________
(2)氧化铜溶于稀硫酸:O2- +2H+=H2O
__________________________
(3)碳酸氢钠溶液与盐酸混合:CO32-+2H+=CO2↑+H2O
__________________________
(4)硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42- =BaSO4↓
__________________________
(5)铜片加入稀硫酸中:Cu+2H+=Cu2++H2↑
__________________________
(6)向氢氧化钡溶液中通入少量CO2:CO2 +OH-=HCO3-
__________________________
(7)氢氧化铁溶于硝酸中:Fe(OH)3+3H+=Fe3++3H2O
__________________________
参考答案:(1)错误;碳酸钙是难溶物,应写成化学式。正确的应为:CaCO3+2H+=Ca2++CO2↑+H2O
(2)错误,氧化铜是氧化物,应写成化学式,正确的为:CuO+2H+=Cu2++H2O
(3)错误,碳酸氢钠电离时,HCO3-不拆开,正确的为:HCO3-+ H+=H2O+CO2↑
(4)错误,漏写氢氧化铜,正确的是:Ba2++2OH-+Cu2++SO42- =BaSO4↓+Cu(OH)2↓
(5)错误,铜与稀硫酸不反应。
(6)错误,少量的CO2与氢氧化钡反应生成碳酸钡,正确的应为:CO2+Ba2++2OH-=BaCO3↓+H2O
(7)正确。
本题解析:
本题难度:一般
2、选择题 下列图示与对应叙述相符的是(?)
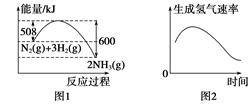
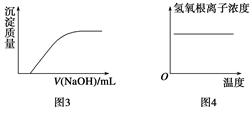
A.图1反应达到平衡后,升高温度,平衡常数K值变大
B.图2表示镁条放入盐酸中生成氢气速率随时间的变化
C.图3表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化
D.图4表示纯碱溶液受热时氢氧根浓度随温度的变化
参考答案:B
本题解析:A项,该反应为放热反应,升温,平衡左移,K减小,错误;B项,镁与盐酸反应是放热反应,升温,速率加快,随反应进行,c(H+)减小,速率减慢,正确;C项,发生Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,一开始就形成沉淀,错误;D项,CO32-+H2O HCO+OH-,升温,平衡右移,c(OH-)增大,错误。
HCO+OH-,升温,平衡右移,c(OH-)增大,错误。
本题难度:一般
3、选择题 下列离子方程式书写正确的是
[? ]
A.铁片放入稀盐酸中:2Fe+6H+===2Fe3++3H2↑
B.大理石放入稀硝酸中:CO32-+2H+===CO2↑+H2O
C.锌片?插入硫酸铜溶液:2Zn+Cu2+===Cu+2Zn2+
D.硫酸铜与氢氧化钡溶液反应:Cu2++SO42-+Ba2++2OH-===Cu(OH)2↓+BaSO4↓
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是
A.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH-=CaCO3↓+H2O
B.氯化铵与氢氧化钠两种浓溶液混合加热:NH4++OH- H2O+NH3↑
H2O+NH3↑
C.氢氧化镁与稀硫酸反应:H+ +OH-=H2O
D.单质铜与稀硝酸反应:Cu+2H+ +2NO3-=Cu2+ +2NO↑+H2O
参考答案:B
本题解析:A 错误,2HCO3-+Ca2+ +2OH-=CaCO3↓+CO32-?+2H2O
B 正确。
C 错误,氢氧化镁不溶于水,应写成分子形式
D 错误,电荷不守恒。
本题难度:一般
5、选择题 下列离子方程式书写正确的是( )
A.氧化铜与盐酸反应:O2-+2H+═H2O
B.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O
C.在稀氨水中通入过量CO2:NH3?H2O+CO2═NH4++HCO3-
D.醋酸和氨水反应:H++OH-═H2O
参考答案:A、氧化铜与盐酸反应的离子方程式为:CuO+2H+═H2O+Cu2+,故A错误;
B、澄清石灰水与稀盐酸反应的离子方程式为:OH-+H+═H2O,故B错误;
C、在稀氨水中通入过量CO2反应的离子方程式为:NH3?H2O+CO2═NH4++HCO3-,故C正确;
D、醋酸和氨水都是弱电解质,醋酸和氨水反应的离子方程式:CH3COOH+NH3?H2O═H2O+CH3COO-+NH4+,故D错误;
故选C.
本题解析:
本题难度:简单