1、选择题 把图2中的物质补充到图1中,可得到一个完整的氧化还原反应离子程式(未配平)。对该氧化还原反应离子方程式的说法不正确的是
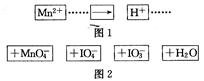
A.IO 作氧化剂
作氧化剂
B.氧化剂和还原剂的物质的量之比为5:2
C.若有2mol Mn2+参加反应,则转移10 mol电子
D.配平后Mn2+、H+的化学计量数分别为2、3
参考答案:D
本题解析:由图示可知,Mn元素化合价升高,所以必然是Mn2+被IO4-氧化为MnO4-:2Mn2++5IO4-+3H2O=2MnO4-+5IO3-+6H+,故答案为D。
点评:本题的关键是要分析出发生的氧化还原反应。
本题难度:简单
2、选择题 以下化学反应的离子方程式书写正确的是( )
A.H2CO3电离:H2CO3?
+2H+
B.将少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑
C.C12溶解于水:H2O+Cl2?2H++ClO-+Cl-
D.向CuSO4溶液中通入H2S:Cu2++H2S═CuS↓+2H+
参考答案:A.H2CO3电离方程式为H2CO3?HCO3-+H+,故A错误;
B.将少量金属钠放入冷水中的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.C12溶解于水的离子反应为H2O+Cl2?H++HClO+Cl-,故C错误;
D.向CuSO4溶液中通入H2S的离子反应为Cu2++H2S═CuS↓+2H+,故D正确;
故选D.
本题解析:
本题难度:一般
3、选择题 下列用来表示物质变化的化学反应中正确的是
A.表示中和热的热化学方程式:H++OH-=H2O △H=-57.3kJ·mol-1
B.硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH-=NH3↑+H2O
C.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
D.足量酸性高锰酸钾溶液与双氧水反应的离子方程式:2MnO4-+5H218O2+6H+=2Mn2++518O2↑+8H2O
参考答案:D
本题解析:书写热化学方程式时,需标明物质的状态,A错;硫酸氢铵中的氢也会与NaOH反应,离子方程式未表示出来,B错;强碱性溶液中不可能生成H+,C错;根据氧化还原反应电子得失守恒,MnO4-恰好将H2O2中的O全部氧化为O2,D正确。
本题难度:一般
4、选择题 下列反应的离子方程式不正确的是(? )
A.Ba(OH)2溶液中加入过量Al2(SO4)3溶液:3Ba2+ + 6OH-+2Al3++3SO42-="3" BaSO4↓+ 2Al(OH)3↓
B.FeCl3溶液中加入过量Na2S溶液: 2Fe3++S2-?= 2Fe2+ + S↓
C苯酚钠溶液中通入少量的CO2:C6H5O-+CO2+H2O→C6H5OH+HCO3-
D.向Ca(OH)2溶液中加入过量的NaHCO3溶液:Ca2++2HCO3-+2OH-=CO32-+CaCO3↓+2H2O
参考答案:B
本题解析:B中硫化钠过量,所以生成物应该是单质硫和硫化亚铁沉淀,B不正确。其余都是正确的,答案选B。
本题难度:一般
5、选择题 下列离子方程式正确的是
A.硫酸与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B.钠与水反应: 2Na+2H2O=2Na++2OH-+H2↑
C.向次氯酸钠溶液中通入足量SO2气体:
D.Ca(HCO3)2溶液中加入少量NaOH溶液: