1、填空题 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-
参考答案:
本题解析:
本题难度:一般
2、选择题 下列装置烧杯中盛放的都是稀硫酸,在铜电极上能产生大量气泡的是(? )
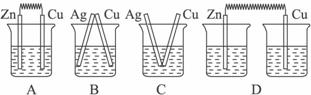
参考答案:A
本题解析:A装置中,Zn比Cu活泼,Zn作负极,失去电子发生氧化反应,Cu作正极,H+在Cu极上得电子发生还原反应,生成H2从而产生大量气泡。B、C中不能发生自发的氧化还原反应,D装置没有形成闭合回路,不能形成原电池,故答案为A项。
本题难度:简单
3、填空题 I.已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)?△H=+140kJ·mol-1
2C(s)+O2(g)=2CO(g)?△H=-221kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式:?。
II.将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
则可以判断该分解反应已经达到平衡状态的是?。
A.2v正(NH3)=v逆(CO2)? B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变? D.密闭容器中氨气的体积分数不变
III.以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。电池的一极通入O2和CO2,电极反应式为:O2+2CO2+4e-=2CO32-;另一极通入丙烷,电极反应式为?;放电时,CO32-移向电池的?(填“正”或“负”)极。
IV.如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
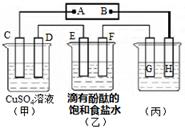
⑴若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为?。
⑵现用丙装置作“铜的电解精炼”,则H应该是?。(填“纯铜”或“粗铜”)。
⑶上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体?L(标准状况)。
参考答案:I.TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g);△H= ? 81kJ·mol-1?(2分)
II.BC?(2分)
III.C3H8+10CO32--20e-===?4H2O+13CO2(2分)负?(1分)
IV.(1)1:2:2:2 (2分)(2)纯铜?(1分)(3)17.92 (2分)
本题解析:I.考查盖斯定律的应用,根据已知反应可知,①+②即得到TiO2(s)+ 2C(s)+2Cl2 (g)=TiCl4(l)+2CO(g);△H= ? 81kJ·mol-1。
II.在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。A中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,不正确。反应前后体积是变化的,因此压强也是变化的,B正确。密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但质量是变化的,C正确。由于反应物是固体,所以氨气的体积分数始终是不变的,D不正确。答案选BC。
III.丙烷失去电子,在负极通入,反应式为C3H8+10CO32--20e-===?4H2O+13CO2。原电池中阴离子向负极移动。
IV.将直流电源接通后,F极附近呈红色,说明F是阴极,则E是阳极,D是阴极,C是阳极,所以A是正极,B是负极,H是阴极,G是阳极。
⑴若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质分别是氧气、铜、氯气和氢气,所以根据电子得失守恒可知,物质的量之比是1:2:2:2。
(2)粗铜精炼时,阴极H应该是纯铜。
(3)向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。说明在反应中除了生成氧气以外,还有氢气生成,其物质的量都是0.2mol。则乙中生成氢气和氯气都是0.4mol,所以体积是17.92L。
本题难度:一般
4、简答题 [选修1化学与生活模块]
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为,280(厲于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子.回答下列问题:
(1)该泉水属于______硬水(填写“暂时”或“永久”)
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是______,原因是______
(3)目前常用阴、阳离子交换树脂来进行硬水的软化.如水中的Ca2+、Mg2可与交换树脂中的交换.当阴离子交换树脂失效后可放入______溶液中再生.
(4)岛上还可以用海水淡化来获得淡水.右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极.请分析下列问题:
①阳离子交换膜是指______?(填A或B);
②写出通电后阳极区的电极反应式:______.

参考答案:(1)因水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度,故答案为:永久;
(2)因除杂时不能引入新的杂质,过量的钙离子通过纯碱来除去,故答案为:先加石灰,后加纯碱;过量的钙离子通过纯碱来形成沉淀除去;
(3)因阴离子交换树脂可以实现阴离子之间的交换,阴离子交换树脂交换出OH-,可用碱溶液使阴离子交换树脂再生,故答案为:碱;
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑.
本题解析:
本题难度:一般
5、选择题 有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为( ? )
A.D>C>A>B? B.D>A>B>C? C.D>B>A>C? D.B>A>D>C
参考答案:B
本题解析:A、B形成原电池,B不易被腐蚀说明活动性A>B;D比A与盐酸反应剧烈说明活动性D>A;铜不能置换出B说明活动性Cu<B;铜能置换出C说明活动性Cu>C,综上可知活动性D>A>B>Cu>C。
点评:原电池中负极失电子被氧化,正极受到保护。
本题难度:一般