1、填空题 工业上由银和硝酸反应制AgNO3,在实际生产中,先要把购进的浓HNO3加入等体积的水,稀释后再跟银反应,在加热条件下使反应完成。
试简要完成下列问题。
(1)为什么不直接用浓HNO3,而用稀HNO3和Ag反应制取AgNO3?
(2)该反应放出的尾气为___________,其中___________和___________在空气里会形成黄色或褐色的烟雾,有很大的毒性,这种烟雾通常被称为___________。NO对人体也有很大危害,NO能跟___________作用生成___________而引起中毒。
2、选择题 下列反应中,属于氮的固定的是(?)
A.空气在雷电的作用下产生NO
B.NH3经催化氧化生成NO
C.NO2和H2O反应生成HNO3
D.由NH3制碳酸铵或硫酸铵
3、选择题 将5.6 g Fe投入浓硝酸溶液,产生红棕色气体A,把所得溶液减压蒸干,得到20g Fe(NO3)2和Fe(NO3)3的混合物,将该固体在高温下加热,得到红褐色的Fe2O3和气体B,A、B气体混合通入水中,剩余气体的体积为(?)mL
A.1120? B. 2240?C.360? D.4480
4、实验题 某实验小组欲探究碳与浓硝酸反应的情况。甲同学设计了图1装置,认为若有红棕色气体产生就说明碳与浓硝酸发生了反应。
(1)乙同学认为甲同学的结论是错误的,他的理由是?(用化学方程式表示),所以他认为应该检验?(填化学式)的产生来证明碳与浓硝酸反应。为此乙同学查阅相关资料得知“0℃时四氧化二氮为液体”,从而改进了实验装置如图2所示。
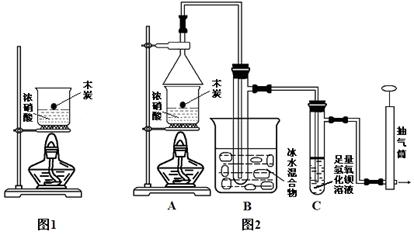
(2)为了减少干扰,对于A装置有下面4种操作方案,其中最合理的是(填写数字序号)?。
①将炭与浓硝酸一同放在装置中加热;②先加热浓硝酸,然后将炭投入其中;
③先加热炭,再加入冷浓硝酸;?④先加热炭,再将炭投入冷浓硝酸。
(3)请用平衡移动原理解释B装置的作用?。
(4)C装置中出现的现象是?,经检测C的溶液中还含有少量氮元素,只以NO3-形式存在,写出生成该离子的化学方程式?。
5、选择题 硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀)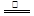 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2 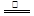 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O?下列有关说法正确的是(?)
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O?下列有关说法正确的是(?)
A.制取等量的硝酸铜,需硝酸的量②最少
B.制取等量的硝酸铜,②产生的有毒气体比①少
C.三种方案中,第③方案最经济环保
D.三种方案的反应都可以在铁质容器中进行