1、选择题 已知2Cu(NO3)2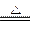 2CuO+4NO2↑+O2↑;带火星的木条在空气中不能复燃,但伸进分解产生的混合气体中,木条能复燃,分析说明(?)
2CuO+4NO2↑+O2↑;带火星的木条在空气中不能复燃,但伸进分解产生的混合气体中,木条能复燃,分析说明(?)
A.NO2具有氧化性
B.NO2具有还原性
C.NO2不发生反应
D.只有O2才能燃烧
参考答案:A
本题解析:因空气中N2和O2的体积比近似为4∶1,但它不能使带火星的木条复燃,而硝酸铜的分解产物中NO2和O2的体积比也为4∶1,但它却能使带火星的木条复燃,由此可以说明NO2能够助燃,即作氧化剂。
本题难度:简单
2、选择题 下列块状金属中,在常温时能全部溶于足量浓HNO3的是
A.Au(金)
B.Cu
C.Al
D.Fe
参考答案:B
本题解析:金和硝酸不反应,铝和铁在浓硝酸中常温下含发生钝化。所以答案是B。
本题难度:一般
3、填空题 盐酸、硫酸和硝酸是三种重要的酸。
(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______;
(3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______;
(4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______;
(5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______;
(6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
参考答案:(1)都要用到H2;
制盐酸用Cl2和H2化合成HCl,制硝酸用氨氧化法,首先制得NH3,而合成NH3必须有H2。
(2)重要设备是吸收塔。(制HNO3那个是氧化炉)
(3)浓H2SO4。
浓H2SO4作吸水剂。
(4)产生白雾。
(5)铁、铝被浓H2SO4或浓HNO3钝化。
(6)SO2。
本题解析:Zn和浓H2SO4共热产生SO2;CaCO3很难与浓H2SO4反应到底;H2S会被浓H2SO4氧化。
本题难度:简单
4、选择题 若以ω1和ω2分别表示浓度为a mol?L-1和b mol?L-1氨水的质量分数,且知2a=b,则下列推断正确的是
A.2ω1 = ω2
B.2ω2 = ω1
C.ω2 > 2ω1
D.ω1 < ω2 < 2ω1
参考答案:C
本题解析:考查质量分数与物质的量浓度的转换
设浓度为a mol?L-1和b mol?L-1氨水的密度分别为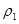 与
与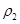 ,对密度小于水的氨水来讲,浓度越大密度越小,故
,对密度小于水的氨水来讲,浓度越大密度越小,故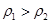 ;
;
由公式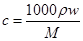 可知,
可知, ,即
,即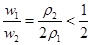 ,故ω2 > 2ω1,答案为C
,故ω2 > 2ω1,答案为C
本题难度:一般
5、实验题 如下图所示,是实验室制备某常见气体的实验装置,请填空:

(1) 该实验装置制备的常见气体是(填写化学式):?。
(2) 制备该气体的化学方程式是:?。
(3) 收集该气体的方法是:?。
(4) 检验该气体是否收集满的方法是:
? ? ? ?。
(5) 将充满该气体的试管倒立于水槽中,可以看到的现象是:
? ? ?。
参考答案:(1)NH3,
(2) 2NH4Cl+ Ca(OH)2 = CaCl2 + 2H2O + 2NH3↑
(3) 向下排空气法
(4) 用湿润的红色石蕊纸看是否变蓝,或用蘸有浓盐酸的玻璃棒靠近,看是否产生白烟。
(5)水面上升,直至充满试管。
本题解析:从该实验图可知,该装置是抽取氨气的实验,2NH4Cl+Ca(OH)2=2NH3↑+CaCl2+2H2O,氨气的收集方法是根据其密度比空气小的特点,选择向下排空气法;检验氨气是否收集满的方法是:用湿润的红色石蕊纸看是否变蓝,或用蘸有浓盐酸的玻璃棒靠近,看是否产生白烟。
(5) 将充满该气体的试管倒立于水槽中,可以看到的现象是:水面上升,直至充满试管,由于氨气极易溶于水的特点,1体积水可以溶解700体积的氨气。
点评:氨气是高中化学常见的特殊气体,本题主要考查氨气的制取及其检验等性质,难度不大,考生可以结合提供的实验图,分析问题,快速解题。
本题难度:一般