1、计算题 已知一个氧原子的质量为2.657×10-26kg,则多少克氧气的物质的量为1mol?(要求根据氧原子的质量进行推算)
参考答案:32g
本题解析:因为1个氧分子含2个氧原子,1 mol O2约含6.02×1023个氧分子,所以有:2.657×10-26kg×2×6.02×1023=31.99×10-3kg="32.0" g。
本题难度:简单
2、选择题 与50mL?0.1mol?L-1?Na2CO3?溶液中Na+的物质的量浓度相同的溶液是( )
A.25mL0.2mol?L-1的NaCl溶液
B.100mL0.1mol?L-1的NaCl溶液
C.25mL0.2mol?L-1的Na2SO4溶液
D.10mL0.5mol?L-1的Na2CO3溶液
参考答案:1mol?L-1?Na2CO3?溶液中Na+的钠离子浓度为0.2mol/L.
A、0.2mol?L-1的NaCl溶液中钠离子浓度为0.2mol/L,故A正确;
B、0.1mol?L-1的NaCl溶液中钠离子浓度为0.1mol/L,故B错误;
C、0.2mol?L-1的Na2SO4溶液中钠离子浓度为0.4mol/L,故C错误;
D、0.5mol?L-1的Na2CO3溶液中钠离子的浓度为1mol/L,故D错误.
故选:A.
本题解析:
本题难度:一般
3、选择题 在t℃时,将a?gNH3完全溶解于水,得V?mL饱和溶液,测得该溶液的密度为ρg/cm3,质量分数为ω,其中n(NH4+)?为b?mol.则下列叙述中错误的是( )
A.溶液中C(OH-)=
mol/L
B.溶质的物质的量浓度C=mol/L
C.溶质的质量分数:ω=×100%
D.上述溶液中再加入VmL水后,所得溶液的质量分数小于0.5ω
参考答案:A、V?mL饱和溶液中n(OH-)=n(H+)+n(NH4+)=[c(H+)×10-3+b]mol,所以c(OH-)=[c(H+)×V×10-3+b]molV×10-3L=1000b+c(H+)VV,故A正确;
B、氨气的物质的量为ag17g/mol=a17mol,所以溶质的物质的量浓度为a17molV×10-3L=1000a17Vmol/L,故B正确;
C、溶液质量为Vml×ρg/ml=ρVg,所以溶质的质量分数为agρVg×100%=100aρV%,故C错误;
D、混合前后溶质的质量不变为ag,水的密度比氨水的密度大,即ρg/cm3<ρ水,等体积Vml混合,混合后溶液的质量大于2ρvg,所以混合后质量分数小于小于0.5ω,故D正确.
故选:B.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是
A.O2的摩尔质量是32
B.摩尔是物质的量的单位
C.1 mol任何物质都约含有6.02x10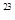 个原子
个原子
D.物质的量浓度为2mol/L的BaCl2溶液中,含有Cl-个数为4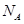 (
(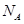 表示阿伏加德罗常数的值)
表示阿伏加德罗常数的值)