1、选择题 对于平衡体系mA(g)+nB(g)?pC(g)+qD(g);△H<0,下列结论不正确的是( )
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来2倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若m+n=p+q,则往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2a
D.若温度不变,压强增大到原来的2倍,达到平衡时,总体积一定比原来的
要小
参考答案:A、将容器的体积缩小到原来的一半,如果平衡不移动,此时A的浓度变为原来的2倍,现在A的浓度为原来的2倍,说明平衡不移动,体积缩小即增大压强,平衡不动,所以m+n=p+q,故A错误;
B、反应开始时,A、B的物质的量之比为m:n,恰好等于方程式的系数值比,这种情况下平衡时,A、B的转化率相等,故B正确;
C、若m+n=p+q,则往含有amol气体时建立的平衡和向平衡体系中加入amol的B时建立的平衡等同,所以往含有amol气体的平衡体系中再加入amol的B,达到新平衡时,气体的总物质的量等于2amol,故C正确;
D、若该反应中,m+n=p+q,温度不变时,压强增大到原来的2倍,达到新平衡时,总体积变为原来的12,故D错误.
故选AD.
本题解析:
本题难度:一般
2、选择题 在一定条件下有可逆反应X(g)+3Y(g) 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),经过2分钟后达平衡,平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.04 mol·L-1,则下列判断不合理的是(?)
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),经过2分钟后达平衡,平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.04 mol·L-1,则下列判断不合理的是(?)
A.平衡时,X与Z的生成速率之比为1∶2
B.v(Z)="0.02" mol·L-1·min-1
C.c1∶c2=1∶3
D.X、Y的转化率相等
参考答案:B
本题解析:平衡时,v(A)表示逆反应速率时与v(C)表示正反应速率时符合1∶2的化学计量数之比,则v(正)=v(逆),A正确。B项:若v(Z)="0.02" mol·L-1,则2 min内Z的浓度增加0.04 mol·L-1,由于起始时c3不为0,则v(Z)≠0.02 mol·L-1·min-1,B项错误。由于X、Y的转化量为1∶3,平衡时X、Y的浓度为1∶3,则说明起始通入的c1和c2之比为1∶3,二者转化率相等。C、D项正确。
本题难度:简单
3、选择题 下列四种情况不能用右图图像表示的是(?)
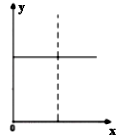
A.N2(g)+3H2(g)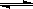 2NH3(g),恒容充入He,N2的转化率与时间的关系
2NH3(g),恒容充入He,N2的转化率与时间的关系
B.CH4(g)+H2O(g)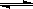 CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与
CO(g)+3H2(g);ΔH>0,平衡后CH4的物质的量与
△H的关系
C.FeCl3+3KSCN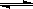 Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系
Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl—)与正反应速率关系
D.H2(g)+I2(g)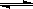 2HI(g),平衡后缩小容器容积,速率与时间的关系
2HI(g),平衡后缩小容器容积,速率与时间的关系
参考答案:D
本题解析:略
本题难度:一般
4、选择题 在容器中充入SO2和只由18O原子组成的氧气18O 2,在一定条件下反应:
2SO2(g) +O 2(g)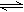 2SO3(g),达到平衡时, 18O存在于(?)
2SO3(g),达到平衡时, 18O存在于(?)
A.只存在于O 2中
B.只存在于O 2和SO3中
C.只存在于SO2和SO3中
D.SO3、SO2和O 2中都有可能存在
参考答案:D
本题解析:由于反应是可逆反应,在生成三氧化硫的同时,三氧化硫又分解生成二氧化硫和氧气,所以 18O在SO3、SO2和O 2中都有可能存在,答案选D。
本题难度:一般
5、选择题 在一定温度下的密闭容器中,加入1mol CO、1 mol H2O发生反应:CO(g)+H2O(g)  CO2(g) +H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
CO2(g) +H2(g),达到平衡时测得n(H2)为0.5 mol,下列说法不正确的是( )
A.在该温度下平衡常数K=1
B.平衡常数与反应温度无关
C.CO的转化率为50%
D.其他条件不变,改变压强平衡不移动
参考答案:B
本题解析:平衡常数只与反应温度有关。
本题难度:一般