1、选择题 下列有关生活生产中的叙述合理的是(?)
A.硫酸工业中SO2转化为SO3时采用常压,是因为增大压强不会提高SO2的转化率。
B.打开啤酒瓶的瓶盖,大量的气泡冒出来,该现象不能用勒夏特列原理解释。
C.氯碱工业:用离子交换膜电解槽电解时,往阳极室注入经过精制的 NaCl溶液,往阴极室注入稀氢氧化钠溶液(或去离子水)。
D.工业上合成氨采用500℃左右的温度,其原因是适当加快NH3的合成速率,催化剂在500℃左右时其活性最好,且能提高H2的转化率。
参考答案:C
本题解析:A:硫酸工业中SO2转化为SO3时采用常压,是因为在常压下,反应物的转化率已经相当高,再增大压强只会增加消耗,但SO2的转化率提高不大;B:啤酒溶液中存在下列平衡:CO2(aq) CO2(g),打开瓶盖,平衡向生成CO2气体的方向移动;D:催化剂只能提高反应速率,但不是不能提高H2的转化率,所以正确选项为C
CO2(g),打开瓶盖,平衡向生成CO2气体的方向移动;D:催化剂只能提高反应速率,但不是不能提高H2的转化率,所以正确选项为C
本题难度:一般
2、选择题 反应aX(g) + bY(g)  ?cZ(g);△H=Q,有下图所示关系,下列判断中正确是(?)
?cZ(g);△H=Q,有下图所示关系,下列判断中正确是(?)

A.a+b < c, Q > 0
B.a+b < c, Q < 0
C.a+b > c, Q > 0
D.a+b > c, Q < 0
参考答案:D
本题解析:观察图可知,P1>P2,T1>T2。如果a+b<c,升高温度和增大压强化学平衡都逆向移动,图像不符合,故A、B项错误。如果a+b > c,根据图像,升高温度,X的量增多,正反应为放热反应,Q < 0,故选D。
点评:本题考查的是化学平衡移动的相关知识,题目难度中等,分析透彻影响化学平衡移动的因素是解题的关键。
本题难度:一般
3、选择题 在容积可变的密闭容器中,1molN2和4molH2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时的氮气的体积分数接近于
A.5%
B.10%
C.15%
D.20%
参考答案:C
本题解析:根据三行式计算。?
N2+3H2 2NH3,
2NH3,
起始量(mol)?1? 4?0
变化量(mol)?1/3? 1? 2/3
平衡量(mol)?2/3? 3? 2/3
根据阿伏加德罗定律:同温同压下,气体的物质的量之比等于体积之比知,平衡时的氮气的体积分数接近15%,选C。
本题难度:一般
4、选择题 在一定温度下,可逆反应X(g)+3Y(g)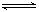 2Z(g)达到平衡的标志是?
2Z(g)达到平衡的标志是?
A.Z生成的速率与X生成的速率相等
B.单位时间生成a mol X,同时生成3a mol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子数比为1∶3∶2
参考答案:C
本题解析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以C正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此D不正确。A中反应速率的方向相反,但不满足速率之比是相应的化学计量数之比,所以不正确。B中反应速率的方向是相同的,因此也不正确。答案选C。
本题难度:一般
5、选择题 在容积一定的密闭容器中,可逆反应A(g)+B(g) xC(g),有下图所示的关系曲线,根据下图下列判断正确的是
xC(g),有下图所示的关系曲线,根据下图下列判断正确的是
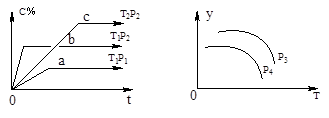
A.p3>p4,y轴表示A的转化率
B.p3>p4,y轴表示混合气体的密度
C.p3<p4,y轴表示B的质量分数
D.p3<p4,y轴表示混合气体的平均摩尔质量
参考答案:A
本题解析:由左图,温度相同时,p2>p1,压强越大,C%越大,所以x=1;压强相同时,T1>T2,温度越高,C%越小,正反应是放热反应。升高温度,A的转化率减小,压强越大,A的转化率越大,A正确;混合气体总质量守恒,容积固定,气体密度不变,B错误;升高温度,平衡向左移动,B的质量分数增大,C错误;升高温度,平衡向左移动,气体物质的量增大,气体总质量不变,平均摩尔质量减小,增大压强,气体摩尔质量增大,p3>p4,D错误。
点评:若图像中有三个变量,先确定一个量不变,再讨论另外两个量的关系。
本题难度:一般