| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《弱电解质电离平衡》考点预测(2019年强化版)(二)
参考答案:D 本题解析:A、碳酸氢钠溶液中存在电离碳酸氢根离子,与偏铝酸根离子发生反应生成碳酸根离子和氢氧化铝沉淀,不可能大量存在,错误;B、若HA为强酸,则C(Na+) =C(A-);若HA为弱酸,则酸的浓度大于氢氧化钠的浓度,则等体积混合,酸过量,所得溶液为HA与NaA的混合液,溶液呈酸性,所以C(Na+) <C(A-),错误;C、醋酸加水稀释,醋酸的电离平衡正向移动,但醋酸根离子、氢离子浓度仍减小,但温度不变,水的离子积常数不变,则氢氧根离子浓度增大,错误;D、t℃时,水的离子积常数为Kw= c(OH-)×c(H+)=[c(OH-)]2,则c(OH-)=c(H+),所以溶液呈中性,正确,答案选D。 本题难度:困难 2、选择题 下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
B.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5 C.碳酸钠溶液中滴加少量氯水的离子方程式为CO2-3 + Cl2+H2O =HCO-3+Cl-+HClO D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO2-4先形成沉淀 参考答案:C 本题解析:A、根据表中醋酸和次氯酸的电离常数知酸性:CH3COOH>HF,根据盐类水解规律:组成盐的酸根对应的酸越弱该盐的水解程度越大知,相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B、向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时醋酸根的水解程度大于醋酸的电离程度,溶液pH>7,错误;C、酸性:HCl>H2CO3>HClO>HCO3—,碳酸钠溶液中滴加少量氯水的离子方程式为CO32—+ Cl2+H2O =HCO-3+Cl-+HClO,正确;D、根据AgCl和Ag2CrO4的Ksp判断向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加AgNO3溶液,Cl-沉淀所需的Ag+浓度应大于1.8×10—5 mol·L-1,CrO42—沉淀所需的Ag+浓度应大于 本题难度:困难 3、选择题 甲酸是一种一元有机酸。下列性质可以证明它是弱电解质的是 参考答案:B 本题解析: 本题难度:一般 4、选择题 在氨水中存在下列电离平衡:NH3·H2O |
参考答案:C
本题解析:加入NH4Cl固体c(NH4+)增大,平衡逆向移动,加NaOH溶液c(OH-)增大,平衡逆向移动,加HCl, c(OH-)减小,平衡正向移动,加CH3COOH溶液,c(OH-)减小,平衡正向移动,加水平衡正向移动,加热氨气挥发,平衡逆向移动,所以答案选C。
考点:影响电离平衡的因素
点评:改变影响平衡移动的一个因素,平衡总是向减弱这种改变的方向移动。
本题难度:一般
5、选择题 相同体积、相同pH的某一元强酸溶液①和某一元中强酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是
[? ]
A.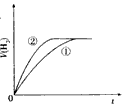
B.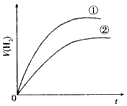
C.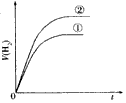
D.
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《反应速率与.. | |