1、选择题 下列各组数据关系中,前者比后者大的是( )
A.纯水100℃和25℃时的pH
B.Na2CO3溶液中的HCO3-和OH-数目
C.常温下pH相同的KOH溶液和CH3COOK溶液中由水电离出的OH-离子浓度
D.100mL?0.01mol/L的CH3COOH溶液与10mL?0.1mol/L的CH3COOH溶液的H+数目
参考答案:A.水的电离是吸热反应,温度越高,水的电离程度越大,则其pH越小,故A错误;
B.碳酸根离子的两步水解中都产生氢氧根离子,只有碳酸根离子的第一步水解中生成碳酸氢根离子,所以碳酸氢根离子数目小于氢氧根离子数目,故B错误;
C.常温下,氢氧化钾抑制水电离,醋酸钾促进水电离,所以pH相同的KOH溶液小于CH3COOK溶液中由水电离出的OH-离子浓度,故C错误;
D.相同温度相同溶质的弱电解质溶液中,溶液越稀,电解质的电离程度越大,所以0.01mol/L的CH3COOH大于1?0.1mol/L的CH3COOH的电离程度,且二者的物质的量相等,所以100mL0.01mol/L的CH3COOH溶液与10mL?0.1mol/L的CH3COOH溶液的H+数目,故D正确;
故选D.
本题解析:
本题难度:简单
2、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液)  ?H+(溶液)+ In-(黄色溶液)
?H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液:?①盐酸②石灰水③NaCl溶液?④NaHSO4溶液?⑤NaHCO3溶液?⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
参考答案:C
本题解析:向溶液中加盐酸、硫酸氢钠溶液、氯化铝(水解生成盐酸)溶液c(H+)都增大,平衡向左移动,指示剂显红色;向溶液中加石灰水、碳酸氢钠溶液(水解生成氢氧化钠)、氨水c(OH-)都增大,平衡向右移动,溶液显黄色;溶液中加入氯化钠溶液平衡不移动,溶液显橙色。
点评:硫酸氢钠在水溶液中相当于一元酸。
本题难度:一般
3、选择题 下列说法正确的是:
A相同温度时,1mol/L氨水与05mol/L氨水中,c(OH-)之比是2:1
B.1mol/L氯化铵 溶液中c(NH4+)=c(Cl-)
C.0.1mol/LCH3COONa溶液中加少量CH3COOH溶液,使溶液呈中性,此时混合液中
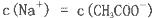
D.硫化钠溶液中,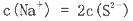
参考答案:C
本题解析:A、氨水为弱电解质,不能完全电离,故A 错误;B、铵根离子水解使溶液显酸性,导致铵根离子浓度小于氯离子,B错误;C、根据电荷守恒知c(Na+)+c(H+)=c(CH3COO-)+c(OH-),溶液呈中性说明c(H+)=c(OH-),c(Na+)=c(CH3COO-),正确;D、硫离子在溶液中会发生水解,故D错误。
本题难度:一般
4、选择题 在醋酸的电离过程中,加入水会使下列比值增大的是
A.c(CH3COOH)/c(CH3COO—)
B.c(CH3COO—)/c(OH—)
C.c(H+)/c(CH3COOH)
D.c(H+)/ c(OH—)