1、填空题 (14分)巳知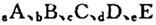 元索,
元索,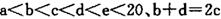 。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
。A2为常温常压下密度最小的气体,B的单质有多种同素异形体,其中一种为质软灰黑色固体。C的最外层电子数是电子层数的2. 5倍。用E的单质制作的餐具不宜长期存放酸性、碱性或咸味食物。
(1) B的原子结构示意图为_________;E在元素周期表中的位置________。
(2) 已知C2及其化合物有以下转化关系(部分物质已省略):

①将已收集满气体Y的试管管口倒扣在水面下,可以观察到的现象是________;其化学反应方程式为________; W的晶体类型为________;将E单质与Z的极稀溶液混合,还原产物只有W,则该反应的离子方程式为________________________。
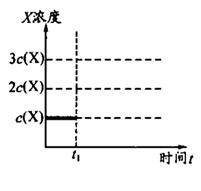
②上述合成X的反应处于平衡状态时,气体X的浓度为C(X)(如图)。在恒温恒容条件下,t1时刻通人X将X的浓度变为2c(X)。请在下图画出平衡移动过程中X浓度的变化趋势图。
(3) 由其中三种元素形成的只含极性键、具有18电子的共价化合物为________ (写结构简式,至少2种)。
2、填空题 短周期元素A、B、C、D在元素周期表中的相对位置如图所示,其中C元素是地壳中含量最多的金属元素。
填写下列空白:
(1)写出D的氧化物的一种用途?
(2)常温下,A的最高价氧化物对应水化物的浓溶液可用C单质制成的容器盛放,原因是??;但NaOH溶液能溶解C的单质,有关的离子方程式为?。
(3)A、B两种元素的气态氢化物结合质子的能力由大到小的顺序为?(填化学式),用一个离子方程式证明?
(4)常温下,A的某种氧化物为红棕色气体,1 mol该气体与水完全反应放出46kJ热量,写出该反应的热化学方程式?
(5)A的气态氢化物为甲,甲遇浓盐酸产生白烟,用电子式表示白烟的化学组成?。常温下,向VL pH=a的甲的水溶液中加入VL pH=b的盐酸,且a+b=14,则反应后溶液的pH?7(填“>”、“<”或“无法确定”),所得溶液中各种离子的浓度由大到小的顺序是??。
3、选择题 元素的性质反映了元素的原子结构,并体现了其在元素周期表中的位置。下列说法正确的是
A.元素周期表中非金属元素都在短周期
B.N、P、As得电子能力减弱。最高价氧化物对应水化物均可表示为H3YO4
C.元素周期表中过渡元素只包括金属元素
D.A一1zX、AzX、A+1zX在元素周期表中的位置、原子核外电子排布相同,但性质不同
4、选择题 用20.0mL,0.100mol/L的含氧酸HnRO4溶液与15.0mL,0.200mol/L的某M(OH)m溶液恰好完全反应全部生成正盐,则用m来表示的R的化合价是(? )
A.+(8-2m/3)
B.+(8-2m)
C.+(8-3m/2)
D.+(8-3m)
5、选择题 同温同压下,等质量的SO2与SO3相比较,下列叙述正确的是
A.含氧原子个数比为2∶3
B.含氧原子个数比为5∶6
C.含硫原子个数比为3∶4
D.含硫元素质量比为5∶4