1、填空题 (11分)工业上将煤气化过程中生成的CO和H2在一定条件下反应制得甲醇,反应的方程式为:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
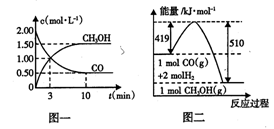
(1)从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2) =____ ;平衡时CO的转化率为____ 。
(2)该反应的平衡常数表达式为 ;若升高反应温度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
(3)若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,则到达平衡状态前该反应向____ (填“正”或“逆”)反应方向进行。
(4)根据图二,甲醇分解的热化学方程式为 。
(5)若以甲醇为原料制成燃料电池,在碱性介质中负极的电极反应式为____ 。
2、选择题 对于反应A(g)+3B(g)  2C(g),下列各数据表示同一反应速率是?
2C(g),下列各数据表示同一反应速率是?
①v(A)="0." 10 mol/(L? min)? ②v(B)="0." 20 mol/(L? min)?
③v(B)=0.30mol/(L?min)? ④v(C)=1.00mol/(L?min)
A.①② ? B.①③? C.③④?D.②④
3、填空题 (I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 大理石规格
| HNO3浓度/mol·L-1
| 实验目的
|
①
| 298
| 粗颗粒
| 2.00
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和__探究温度对该反应速率的影响;
(Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。
|
②
| ?
| ?
| ?
|
③
| ?
| 粗颗粒
| ?
|
④
| ?
| ?
| ?
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)NO的平衡浓度c(NO)=?;
(2)用O2表示从0~2s内该反应的平均反应速率为?;
(3)右图中表示NO2变化的曲线是?;
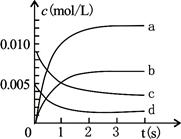
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V?②体积不变充入He气体 V?
4、选择题 在一定温度下的容积不变的密闭容器中进行反应2X(g) 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
A.等于20s
B.等于18s
C.大于20s
D.大于 18s
5、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
( )
| 反应物
催化剂 | 温度
①
10mL10%?H2O2溶液
无
25℃
②
10mL20%?H2O2溶液
无
25℃
③
10mL20%?H2O2溶液
无
40℃
④
10mL20%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
40℃
|
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的原因不仅仅是实验④加入了催化剂
D.FeCl3不但可以催化H2O2分解,也能催化Zn与盐酸反应制H2