1、选择题 10mL浓度为1mol?L-1的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的3mol?L-1的硫酸
B.加入适量蒸馏水
C.加入数滴硫酸铜溶液
D.加入适量的硫酸钠溶液
参考答案:A.加入适量的3mol.L-1的硫酸,增大氢离子的浓度,也增大了氢离子的物质的量,故A错误;
B.加入适量蒸馏水,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故B错误;
C.加入数滴硫酸铜溶液,Zn足量,构成Cu、Zn原电池,加快反应速率,且没有改变氢离子的物质的量,不影响生成的氢气的总量,故C正确;
D.加入适量的硫酸钠溶液,氢离子的浓度减小,不改变氢离子的物质的量,化学反应速率减小,故D错误;
故选C.
本题解析:
本题难度:一般
2、选择题 CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
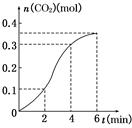
A.反应开始2 min内平均反应速率最大
B.反应速率先增大后又减小
C.反应开始4 min内温度对反应速率的影响比浓度大
D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1
参考答案:A
本题解析:首先要看明白图像,图中的曲线表明,二氧化碳的产生速率先快后慢。在第一个2 min内产生了0.1 mol CO2,第二个2 min内产生了0.2 mol CO2,第三个2 min内产生了0.05 mol CO2,反应速率先增大后减小;先增大是由于反应放热,使溶液温度升高,导致反应速率增大,4 min后速率下降则是由于浓度降低所引起的,通过计算知,A项错误,应该是2 min~4 min的平均速率最大。
本题难度:一般
3、选择题 某恒容器中充入1molA和2molB发生反应:A(g)+2B(g)?2C(g)△H<0;下列图象能正确表达其含义的是( )
A.

B.

C.
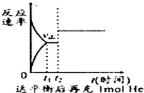
D.
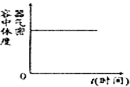
参考答案:A、由图象可知,温度T2到达平衡时间短,故图象中T1<T2,且升高温度,混合气体的平均摩尔质量减小,说明升高温度平衡向逆反应方向移动,该反应正反应是放热反应,升高温度平衡向逆反应移动,图象与实际相符合,胡A正确;
B、反应热△H与化学计量数有关,化学计量数一定,相同条件下对同一反应而言△H为你定值,与参加反应的反应物的物质的量无关,故B错误;
C、恒温恒容下,充入惰性气体,反应混合物各组分的浓度不变,反应速率不变,故C错误;
D、反应混合气体的总质量不变,容器的容积不变,密度数值为定值,故D正确;
故选AD.
本题解析:
本题难度:简单
4、选择题 某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是(?)
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是(?)
A.前2 min,D的平均反应速率为0.2 mol/(L·min)
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动
D.增加B,平衡向右移动,B的平衡转化率增大
参考答案:B
本题解析:由方程式可知,当反应生成1.6 mol C时,同时生成0.4 mol D,则:
3A(g)?+? 2B(g)  4C(s)+D(g)
4C(s)+D(g)
起始: 2 mol/L ?1 mol/L?0
变化: 0.6 mol/L ?0.4 mol/L ?0.2 mol/L
平衡: 1.4 mol/L ?0.6 mol/L?0.2 mol/L
故前:2 min,D的平均反应速率为:
 =0.1? mol/(L·min),
=0.1? mol/(L·min),
B的转化率: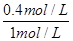 ×100%=40%;由于C为固体,故增大压强,平衡正移;增加B,平衡向右移动,A的转化率增大,但B的转化率降低。
×100%=40%;由于C为固体,故增大压强,平衡正移;增加B,平衡向右移动,A的转化率增大,但B的转化率降低。
本题难度:一般
5、选择题 反应:A+3B?2C+D,在四种不同情况下的反应速率分别为:
①vA=0.15mol?L-1?min-1
②vB=0.6mol?L-1?min-1
③vC=0.4mol?L-1?min-1
④vD=0.45mol?L-1?min-1
该反应进行得最快的是( )
A.①
B.④
C.①④
D.②③
参考答案:以B为标准进行比较,对于A+3B?2C+D,
①v(A)=0.15mol/(L?min),速率之比等于化学计量数之比,故v(B)=3v(A)=0.45mol/(L?min),
②v(B)=0.6mol/(L?min),
③v(C)=0.4mol/(L?min),速率之比等于化学计量数之比,故v(B)=32v(C)=32×0.4mol/(L?min)=0.6mol/(L?min),
④v(D)=0.45mol/(L?min),速率之比等于化学计量数之比,故v(B)=3v(D)=1.35mol/(L?min),
故④最快,
故选B.
本题解析:
本题难度:简单