1、填空题 (11分)工业上将煤气化过程中生成的CO和H2在一定条件下反应制得甲醇,反应的方程式为:CO(g)+2H2(g) CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:
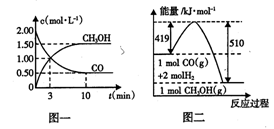
(1)从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2) =____ ;平衡时CO的转化率为____ 。
(2)该反应的平衡常数表达式为 ;若升高反应温度,该反应的平衡常数将 (填“增大”、“减小”或“不变”)。
(3)若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,则到达平衡状态前该反应向____ (填“正”或“逆”)反应方向进行。
(4)根据图二,甲醇分解的热化学方程式为 。
(5)若以甲醇为原料制成燃料电池,在碱性介质中负极的电极反应式为____ 。
参考答案:(1)0.3 mol/(L?min) ,75% (2)c(CH3OH)/c(CO)·c2(H2),减小 (3)逆 (4)CH3OH(g)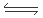 CO(g)+2H2(g) ΔH="+91" KJ/mol (5)CH3OH+8OH- -6e-=CO32-+6H2O
CO(g)+2H2(g) ΔH="+91" KJ/mol (5)CH3OH+8OH- -6e-=CO32-+6H2O
本题解析:(1)从反应开始到平衡,用CO浓度变化表示的平均反应速v(CO)=(2.00-0.50)mol/L÷10min=0.15mol/(L?min);由于v(H2)=2V(CO),所以v(H2)=" 0.3" mol/(L?min);平衡时CO的转化率为(1.5mol/L÷2.00mol/L)×100%=75%,(2)该反应的平衡常数表达式为K=c(CH3OH)/c(CO)·c2(H2),由于反应物的能量高于生成物,所以该反应是放热反应。根据平衡移动原理,若升高反应温度,平衡向吸热的逆反应方向移动,该反应的平衡常数将减小;(3)由于反应前后气体的质量不变,若在一定温度下,向一恒压容器中充人1 mol CO、2mol H2和1 mol CH3OH,反应达到平衡时,测得混合气体的密度是同温同压下起始混合气体密度的0.8倍,密度减小,说明反应后气体的体积增大,反应逆向进行,为使越强与原来相等就应该扩大容器的容积,故到达平衡状态前该反应向逆反应方向进行。(4)根据图二可知1mol的甲醇分解产生1mol的CO和2mol的H2,反应需要吸热(510-419)KJ=91 KJ,所以甲醇分解的热化学方程式为CH3OH(g)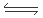 CO(g)+2H2(g) ΔH="+91" KJ/mol ;(5)若以甲醇为原料制成燃料电池,通入甲醇的电极为负极,在碱性介质中负极的电极反应式为CH3OH+8OH- -6e-=CO32-+6H2O。
CO(g)+2H2(g) ΔH="+91" KJ/mol ;(5)若以甲醇为原料制成燃料电池,通入甲醇的电极为负极,在碱性介质中负极的电极反应式为CH3OH+8OH- -6e-=CO32-+6H2O。
考点:考查化学反应速率的计算、物质的平衡转化率、反应进行的方向的判断、热化学方程式的书写及原电池反应的电极式的书写的知识。
本题难度:困难
2、选择题 对于反应A(g)+3B(g)  2C(g),下列各数据表示同一反应速率是?
2C(g),下列各数据表示同一反应速率是?
①v(A)="0." 10 mol/(L? min)? ②v(B)="0." 20 mol/(L? min)?
③v(B)=0.30mol/(L?min)? ④v(C)=1.00mol/(L?min)
A.①② ? B.①③? C.③④?D.②④
参考答案:B
本题解析:反应速率之比等于化学计量数之比则表示的为同一反应速率,或将所给反应速率均转化为A的反应速率进行判断,故答案选B。
本题难度:一般
3、填空题 (I)(10分)某自主学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL,大理石用量为10.00g。请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
实验编号
| T/K
| 大理石规格
| HNO3浓度/mol·L-1
| 实验目的
|
①
| 298
| 粗颗粒
| 2.00
| (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响;
(Ⅱ)实验①和__探究温度对该反应速率的影响;
(Ⅲ)实验①和__探究大理石规格(粗、细)对该反应速率的影响。
|
②
| ?
| ?
| ?
|
③
| ?
| 粗颗粒
| ?
|
④
| ?
| ?
| ?
|
(II)(5分) 800℃时在2 L密闭容器内加入NO和O2,发生反应:2NO(g)+O2(g) 2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
2NO2(g),正反应放热。测得n(NO)随时间的变化如下表,请回答:
时间/s
| 0
| 1
| 2
| 3
| 4
| 5
|
n(NO)/mol
| 0.020
| 0.010
| 0.008
| 0.007
| 0.007
| 0.007
|
(1)NO的平衡浓度c(NO)=?;
(2)用O2表示从0~2s内该反应的平均反应速率为?;
(3)右图中表示NO2变化的曲线是?;
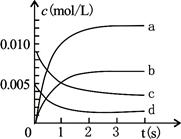
(4)在其他条件不变,5min时分别改变下列条件,将改变条件后反应速率的变化情况(“增大”、“减小”或“不变”)填入空格内:①升温 V?②体积不变充入He气体 V?
参考答案:(15分)(每空1分)(I)
实验编号
T/K
大理石规格
HNO3浓度/mol·L-1
实验目的
①
298
粗颗粒
2.00
⑴实验①和②探究HNO3浓度对该反应速率的影响;
⑵实验①和③探究温度对该反应速率的影响。
⑶实验①和④探究大理石规格(粗、细)对该反应的影响。
②
298
粗颗粒
1.00
③
308
粗颗粒
2.00
④
298
细颗粒
2.00
(II)0.0035mol·L-1?(2)0.0015mol·L-1·s-1;(3)b?(4) 增大?不变
本题解析:(I)要探究温度对该反应速率的影响,则其它条件应该是相同的,所以实验①和③探究温度对该反应速率的影响;要探究探究大理石规格(粗、细)对该反应速率的影响,其它条件应该是相同的,所以实验①和④探究大理石规格(粗、细)对该反应的影响。
(II)(1)根据比值数据可知,反应进行到3s时达到平衡状态,则NO的平衡浓度c(NO)=0.007mol÷2L=0.0035mol/L。
(2)从0~2s内NO的物质的量减少了0.020mol-0.008mol=0.012mol,则氧气减少了0.006mol,所以用氧气表示的反应速率是 。
。
(3)平衡时NO2的物质的量增加了0.020mol-0.007mol=0.013mol,浓度是0.013mol÷2L=0.0065mol/L,所以b曲线符合。
(4)升高温度,反应速率增大。体积不变充入He气体,压强增大,但物质的浓度是不变的,因此反应速率不变。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,贴近高考,在注重对学生基础知识的巩固和训练的同时,侧重对学生基础知识的巩固和训练。有利于调动学生的逻辑推理能力和发散思维能力,提高学生灵活运用基础知识解决实际问题的能力。该类试题主要是考查学生能够敏捷、准确地获取试题所给的相关信息,并与已有知识整合,在分析评价的基础上应用新信息的能力。
本题难度:一般
4、选择题 在一定温度下的容积不变的密闭容器中进行反应2X(g) 2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
2Y(g)+Z(g),若Y浓度由0.048mol·L-1增加到0.12 mol·L-1需18s,那么由由0.12mol·L-1增加到0.2mol·L-1,需要反应的时间是
A.等于20s
B.等于18s
C.大于20s
D.大于 18s
参考答案:C
本题解析:由于随着反应的进行,反应物的浓度逐渐降低,所以反应速率逐渐降低,因此有 >
> ,解得t>20s,答案选C。
,解得t>20s,答案选C。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生应试能力。该题的关键是明确反应速率与反应进程的关系,然后灵活运用即可。
本题难度:简单
5、选择题 某实验小组以H2O2分解为例,研究浓度、催化剂、温度对反应速率的影响.按照如下方案完成实验.下列说法不正确的是
( )
| 反应物
催化剂 | 温度
①
10mL10%?H2O2溶液
无
25℃
②
10mL20%?H2O2溶液
无
25℃
③
10mL20%?H2O2溶液
无
40℃
④
10mL20%?H2O2溶液
1mL0.1mol?L-1FeCl3溶液
40℃
|
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的原因不仅仅是实验④加入了催化剂
D.FeCl3不但可以催化H2O2分解,也能催化Zn与盐酸反应制H2
参考答案:A、由表中数据可知,实验④中浓度最高、温度最高且使用催化剂,故反应速率最快,故A正确;
B、由表中数据可知,实验①中浓度最低、温度最低且没有使用催化剂,故反应速率最慢,故B正确;
C、由表中数据可知,实验②、④的不同之处是④中使用催化剂、温度比实验②中高,故实验②速率小于实验④的原因有催化剂、温度的影响,故C正确;
D、催化剂具有专一性,FeCl3可以催化H2O2分解,但不一定是其它反应的催化剂,FeCl3与Zn与发生反应,不能催化Zn与盐酸反应,故D错误.
故选D.
本题解析:
本题难度:简单