|
|
|
高考化学知识点总结《盐类水解的原理》高频考点巩固(2019年模拟版)(九)
2019-05-30 03:40:15
【 大 中 小】
|
1、填空题 (14分)以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)?4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式 .
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则 .
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
序号
| 第一组
| 第二组
| 第三组
| 第四组
| t/℃
| 30
| 40
| 50
| 80
| NH3生成量/(10
|
2、选择题 200mL0.1 mol·L-1CH3COOH与200mL0.1 mol·L-1NaOH溶液混合后,离子浓度关系正确的是
A.c(Na+) = c(CH3COO-)+ c(CH3COOH)
B.c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C.c(Na+)+ c(OH-)= c(CH3COO-)+ c(H+)
D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
|
3、选择题 0.1?mol·L-1的下列物质的水溶液中,氢离子浓度最大的是
A.NH3·H2O
B.NH4Cl
C.HCl
D.HCOOH
4、填空题 (12分)已知二元酸H2A在水中存在以下电离:H2A===H++HA-,HA-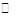 H++A2-。试回答下列问题: H++A2-。试回答下列问题:
(1)NaHA溶液呈__ _(填“酸”“碱”或“中”)性,理由是 。
(2)某温度下,向10 mL、0.1 mol·L-1 NaHA溶液中加入0.1 mol·L-1 KOH溶液V mL至中性,此时溶液中以下关系一定正确的是 (填字母)。
A.溶液pH=7
B.水的离子积Kw=c2(OH-)
C.V>10
D.c(K+) =c(Na+)
|
(3)已知难溶物CaA在水中存在溶解平衡:CaA(s)
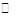
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+)
(填“减小”、“增大”或“不变”),原因是
。
(4)测得25℃时,CaA的Ksp为2.0×10-11。常温下将10gCaA固体投入110mLCaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.08 mol·L-1,则溶液中c(A2-)=
。
5、填空题 【化学——选修2:化学与技术】(15分)
无水AlCl3易升华,可用作有机合成的催化剂等。工业上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
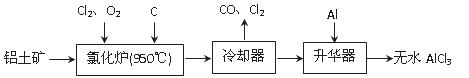
(1)氯化炉中Al2O3、C12和C反应的化学方程式为 。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是 。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 、 。
②AlCl3产品的纯度为 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 。
(6)生铁中含有一种铁碳化合物(Fe3C),工业上要测定碳元素的质量分数,第一步是在足量的空气中煅烧,生成有磁性的固体,该反应的化学方程式是 。
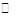 Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。
Ca2+(aq)+A2-(aq) ΔH>0。一定温度下向浊液中通入HCl气体,c(Ca2+) (填“减小”、“增大”或“不变”),原因是 。