1、实验题 某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
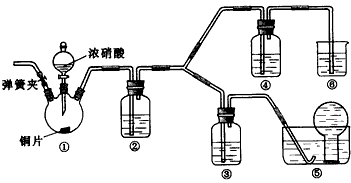
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后_________________。
(3)装置①中发生反应的化学方程式是__________________。
(4)装置②的作用是_________________,发生反应的化学方程式是______________________。
(5)该小组得出的结论所依据的实验现象是______________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液 中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。来源:91考试网 91exam.org这些方案中可行的是(选填序号字母)______________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
参考答案:(1)3mol·L-1稀硝酸、浓硝酸、氢氧化钠溶液
(2)通入CO2 一段时间,关闭弹簧夹,将装置⑤中的导管末端伸入倒置的烧瓶内
(3)Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O
(4)将NO2转化为NO;3NO2+H2O=2HNO3+NO
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体有无色变为红棕色
(6)acd
本题解析:
本题难度:一般
2、选择题 符合如下实验过程和现象的试剂组是( )
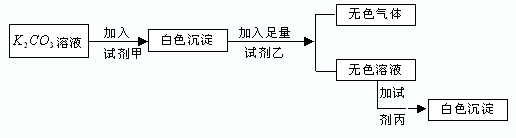
| 甲 | 乙 | 丙
A.MgCl2
HNO3
K2SO4
B.BaCl2
HNO3
K2SO4
C.NaNO3
H2SO4
Ba(NO3)2
D.BaCl2
HCl
CaCl2
|
A.A
B.B
C.C
D.D
参考答案:A.碳酸钾与氯化镁反应生成碳酸镁沉淀,加入硝酸反应生成硝酸镁溶液,加入硫酸钾不反应,故A错误;
B.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入硝酸反应生成硝酸钡溶液,加入硫酸钾生成硫酸钡沉淀,故B正确;
C.碳酸钾与硝酸钾不反应,故C错误;
D.碳酸钾与氯化钡反应生成碳酸钡沉淀,加入盐酸反应生成氯化钡溶液,加入氯化钙不反应,故D错误.
故选B.
本题解析:
本题难度:一般
3、实验题 硫酸铵是一种常用的铵态氮肥。下表是硫酸铵化肥品质的主要指标。?

⑴某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
[观察外观] 该硫酸铵化肥无可见机械杂质。
[实验探究]按下图所示装置进行实验。
①烧瓶内发生反应的离子方程式为:___________________。烧杯中盛放的试剂最好是______(填“浓硫酸”、 “稀硫酸”或“水”)
②实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是____________。
[交流讨论]
③甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:____________;
④乙同学:实验装置中还存在另一个明显缺陷是:______________;经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
[探究结论]
⑤称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥_________(填“是”或“不是”)一等品。

⑵某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉末制成CaSO4悬浊液,然后按如下工艺流程进行产生:
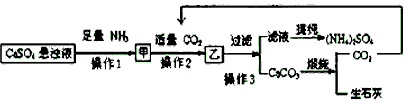
①操作1与操作2的顺序能否调换?______(填能与否),理由是______。
②常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3g和2.1×10-1g,请解析CaSO4向CaCO3转化的原因。________________。
③ 从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是________________。
参考答案:(1)①NH4++OH- NH3
NH3 +H2O; 稀硫酸
+H2O; 稀硫酸
②使NH4+完全反应,并使NH3从溶液中溢出
③产生的氨气中带有水蒸汽,A、B间缺少一个干燥装置
④烧瓶和导管中有氨气残留,不能完全被稀硫酸吸收
⑤不是
(2)①否;氨气在水中的溶解度大,产量高
②由于CaCO3溶解度小,Ca2+更易与CO32-结合生成沉淀,促使CaSO4溶解
③用生石灰制备CaSO4
本题解析:
本题难度:一般
4、简答题 如图实验装置用于验证某些物质的性质.在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片.试回答下列问题:
(1)在A试管内发生反应的化学方程式是______.
(2)B装置的作用是______.
(3)在双球干燥管内发生反应的化学方程式为______.
(4)双球干燥管内观察到的实验现象是______;上述实验现象说明:______.
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是:______.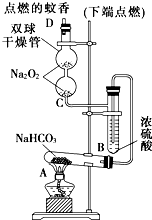
参考答案:(1)依据装置分析判断是加热碳酸氢钠固体的反应生成碳酸钠和二氧化碳水;
反应的化学方程式为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑;故答案为:2NaHCO3?△?.?Na2CO3+H2O+CO2↑;
(2)B中盛的是浓硫酸起到吸收水蒸气干燥二氧化碳气体;故答案为:吸收气体中的水蒸气(干燥CO2)
(3)过氧化钠和二氧化碳反应生成碳酸钠和氧气;反应的化学方程式为:2Na2O2+2CO2═2Na2CO3+O2;
故答案为:2Na2O2+2CO2═2Na2CO3+O2;
(4)过氧化钠是淡黄色固体,随反应进行变为白色固体碳酸钠,反应生成氧气具有助燃性,蚊香燃烧更剧烈;
故答案为:淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈;
(5)氧化钠和二氧化碳反应生成碳酸钠,无氧气生成,在二氧化碳环境,蚊香逐渐熄灭;
故答案为:点燃的蚊香逐渐熄灭;
本题解析:
本题难度:一般
5、填空题 如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块铜片,再用滴管滴入10mL稀硝酸。据此回答下列问题:

(1)实验中观察到的现象是?;
(2)产生上述现象的原因是?;
(3)写出有关反应的化学方程式?;
(4)由实验推知,反应后产物的总能量?(填“大于”、“小于”、“等于”)硝酸和铜片的总能量。
(5)该装置有明显的不足,原因是?,改进的方法是?。
参考答案:(1)铜片表面有气泡冒出,过一会儿,试管口附近有红棕色气体出现;烧杯中有晶体析出。
(2)铜片和稀硝酸反应生成NO,NO被氧气氧化为NO2;同时该反应放热,使烧杯内饱和石灰水的温度升高,氢氧化钙溶解度减小而析出。
(3)3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,2NO+O2=2NO2
(4)小于
(5)NO、NO2逸散到空气中,会造成环境污染;在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中。
本题解析:铜片和稀硝酸反应有无色气体NO析出:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故在铜片表面有气泡冒出;
NO迅速被氧气气氧化为红棕色的NO2:2NO+O2=2NO2,在试管口附近有红棕色气体出现;
由于试管内反应放热,而氢氧化钙溶解度随温度升高而减小,故烧杯饱和石灰水溶液中有晶体析出
(4)对于放热反应来讲,反应物的总能量大于生成物的总能量
(5)由于氮的氧化物均有毒,会造成空气污染,为此,可在试管上加一双孔塞,用导气管将生成的气体导入到氢氧化钠溶液中
本题难度:简单