1、实验题 某化学兴趣小组为探究盛装浓硫酸的铁质材料(碳素钢)与热浓硫酸的反应,设计如下实验。
(1)甲同学没计图一实验装置收集反应产生的气体,写出加热条件下碳素钢与浓硫酸反应生成混合气体的化学方程式_____________________。
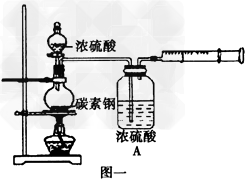
(2)乙同学设计图二实验装置检验甲同学所收集的气体的成分
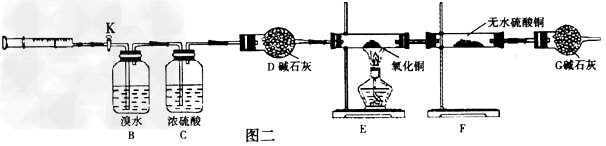
①实验前向B中注入氮气使整个装置充满氮气,实验中将收集到的气体缓缓注入B中,当收集到的气体全部注入B后,还要不断缓缓向B中注入氮气,前后两次向装置中注入氮气,前次的作用是____________,后次的作用是__________________,
②装置B的作用是_________,反应的离子方程式为___________________,
③装置D的作用是__________,装置G的作用是_____________,
④若混合气体中含有氢气,实验过程中能观察到的现象是__________________。
(3)丙同学通过测定混合气体的体积、装置B、D增重的质量来探究混合气体的组成。实验前量取448mL(标准状况下)气体,实验后测得装置B增重0.96g、装置D增重0.088g。
①混合气体中H2的体积分数为_______________;
②若图二实验装置中没有装置C,对实验结果的影响是_______________。
2、选择题 下列实验方案中,不能达到实验目的的是
选项
| 实验目的
| 实验方案
|
A
| 检验CH3CH2Br在NaOH溶液中是否发生水解
| 将CH3CH2Br与NaOH溶液共热。冷却后,取出上层水溶液用稀HNO3酸化加入AgNO3溶液,观察是否产生淡黄色沉淀
|
B
| 检验Fe(NO3)2晶体是否已氧化变质
| 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红
|
C
| 验证Br2的氧化性强于I2
| 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置。可观察到下层液体呈紫色
|
D
| 验证Fe(OH)3的溶解度小于Mg(OH)2
| 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色
3、实验题 某研究性学习小组设计了一组实验来探究元素周期律。甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用下图装置完成了O元素的非金属性比S强的实验研究。回答下列问题:

(1)图中D装置在实验中的作用是________________。
(2)从以下所给物质中选出甲同学设计的实验所用到物质:图中试剂A为_________;试剂C为_________(填序号)。
①稀HNO3溶液?②稀盐酸?③碳酸钙?④Na2SiO3溶液?⑤SiO2?
(3)写出烧瓶中发生反应的离子方程式____________________。写出试管C中发生反应的离子方程式___________________________。由此判断,元素N、C、Si?非金属性由弱到强的顺序为___________。
(4)乙同学设计的实验所用到试剂A为________;试剂B为________;试剂C为________。 C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为______________。
4、简答题 硫代硫酸钠(Na2S2O3)俗称保险粉,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等.实验室可通过如下反应制取:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2.
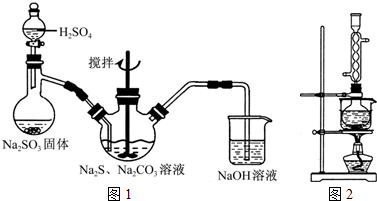
(1)用图1所示装置制取Na2S2O3,其中NaOH溶液的作用是______.如将分液漏斗中的H2SO4改成浓盐酸,则三颈烧瓶内除Na2S2O3生成外,还有______(填化学式)杂质生成.
(2)为测定所得保险粉样品中Na2S2O3?5H2O的质量分数,可用标准碘溶液进行滴定,反应方程式为2Na2S2O3+I2═2NaI+Na2S4O6.
①利用KIO3、KI和HCl可配制标准碘溶液.写出配制时所发生反应的离子方程式:______.
②准确称取一定质量的Na2S2O3?5H2O样品于锥形瓶中,加水溶解,并滴加______作指示剂,用所配制的标准碘溶液滴定.滴定时所用的玻璃仪器除锥形瓶外,还有______.
③若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3?5H2O的质量分数的测量结果______(填“偏高”“偏低”或“不变”).
(3)本实验对Na2S的纯度要求较高,利用图2所示的装置可将工业级的Na2S提纯.已知Na2S常温下微溶于酒精,加热时溶解度迅速增大,杂质不溶于酒精.提纯步骤依次为:
①将已称量好的工业Na2S放入圆底烧瓶中,并加入一定质量的酒精和少量水;
②按图2所示装配所需仪器,向冷凝管中通入冷却水,水浴加热;
③待______时,停止加热,将烧瓶取下;
④______;
⑤______;
⑥将所得固体洗涤、干燥,得到Na2S?9H2O晶体.
5、简答题 孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物.实验室以孔雀石为原料制备CuSO4?5H2O及CaCO3,步骤如下:
请回答下列问题:
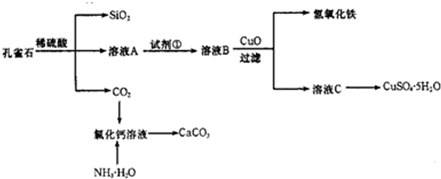
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+.从下列所给试剂中选择:实验步骤中试剂①为______(填代号),检验溶液A中Fe3+的最佳试剂为______(填代号).
a.KMnO4 b.(NH4)2S c.H2O2 d.KSCN
(2)由溶液C获得CuSO4?5H2O,需要经过加热蒸发、______、过滤等操作.过滤时为了防止滤液飞溅,应______.
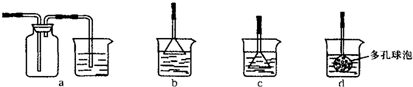
(3)制备CaCO3时,若实验过程中有氨气逸出,应选用下列______装置吸收(填代号).
(4)欲测定溶液A中Fe2+的浓度,需要用容量瓶配制KMnO4标准溶液进行氧化还原滴定,配制时等液面接近容量瓶刻度线时,应该继续进行的操作是______.滴定时需要用用KMnO4标准溶液润洗滴定管,润洗后的废液应从酸式滴定管的______排出.
|