1、选择题 在恒容密闭容器中,反应CO2(g)+3H2(g) CH3OH(g)+H2O(g)?△H<0达到平衡后,改变某一条件,下列说法正确的是
CH3OH(g)+H2O(g)?△H<0达到平衡后,改变某一条件,下列说法正确的是
A.升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动
B.升高温度,可提高CO2转化率
C.增加H2的浓度,可提高CO2转化率
D.改用高效催化剂,可增大反应的平衡常数
参考答案:C
本题解析:A、升高温度,正、逆反应速率均增加,平衡向吸热的方向移动即平衡逆向移动,A错误;B、升高温度,平衡向吸热的方向移动即平衡逆向移动,CO2转化率降低,B错误;C、增加H2的浓度,平衡正向移动,CO2转化率升高,C正确;D、催化剂能加快化学反应速率,不能影响化学平衡,且平衡常数只与温度有关,D错误。
本题难度:一般
2、选择题 在2L密闭容器内,某气体反应物在2s内由8mol变为7.2mol,则该反应的平均反应速率为()
A.0.4mol/(L·s)
B.0.3mol/(L·s)
C.0.2mol/(L·s)
D.0.1mol/(L·s)
参考答案:C
本题解析:反应速率通常用单位时间内浓度的变化量来表示,所以反应速率等于
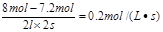 ?,答案选C。
?,答案选C。
本题难度:一般
3、选择题 四个体积相同的密闭容器中,在一定条件下发生反应:N2+3H2 2NH3,反应开始时,反应速率最大的是
2NH3,反应开始时,反应速率最大的是
[? ]
温度(℃)?
N2 (mol)
H2(mol)
?催化剂
A.
500
2
6
有
B.
500?
1.5
4.5
无
C.
450?
1.5
4.5
无
D.
450?
2
6
无
参考答案:A
本题解析:
本题难度:一般
4、选择题 以下说法正确的是( )
A.不能自发进行的反应属于吸热反应
B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于放热反应
C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大
D.催化剂通过改变反应路径,使反应速率增大,但不改变反应所需的活化能
参考答案:C
本题解析:A.不能自发进行的反应不一定属于吸热反应,错误;B.化学键断裂时吸收的能量大于化学键形成时放出的能量的反应属于吸热反应,错误;C.升高反应的温度,活化分子百分数增加,分子间有效碰撞的几率提高,反应速率增大,正确;D.催化剂通过改变反应路径,使反应速率增大,改变反应所需的活化能,错误。
考点:考查反应热与键能、温度、活化能等关系的知识。
本题难度:一般
5、填空题 用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断______段化学反应速率最快,______段收集的氢气最多.
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是______,一定时间后反应速率逐渐减慢,其原因是______.
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是______
A.蒸馏水?B.氯化钠固体?C.氯化钠溶液?D.浓盐酸?E.降低温度
(4)EF段产生H2的反应速率为______mL?min-1.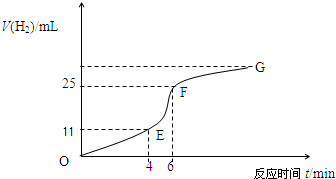
参考答案:(1)根据纵坐标的高低判断收集气体的多少,纵坐标越高,收集的气体越大,所以是EF段;根据图象斜率判断反应速率的大小,斜率越大,反应速率越快,所以是EF段,故答案为:EF段;EF段;
(2)影响EF段速率变化主要因素是:该反应是放热反应,温度越高,反应速率越快,所以温度的改变是改变反应速率的主要原因;影响FG段速率变化主要因素是:随着反应的进行,盐酸的浓度逐渐减小,浓度越小,反应速率越小,所以浓度的改变是改变反应速率的主要原因;
故答案为:该反应是放热反应,温度升高,反应速率加快;随着反应的进行,盐酸的浓度逐渐减小,反应速率逐渐减小.
(3)反应物的浓度越大,反应速率越快,所以只要使反应物浓度变小即可.
A、加蒸馏水,盐酸浓度变小,反应速率减小,故A正确;
B、加氯化钠固体,盐酸浓度不变,反应速率不变,故B错误;
C、加氯化钠溶液,溶液体积增大,盐酸浓度降低,反应速率减小,故C正确;
D、加浓盐酸,盐酸浓度增大,反应速率加快,故D错误;
E、温度降低,化学反应速率减小,故E正确;
故答案为:ACE;
(3)因V=△V△t=14ml2min=7.0ml?min-1,故答案为:7.0.
本题解析:
本题难度:一般