1、填空题 分一定温度下,在容积为VL的密闭容器中进行反应:aN(g) bM(g),N、M的物质的量随时间的变化曲线如图所示:
bM(g),N、M的物质的量随时间的变化曲线如图所示:
(1)此反应的化学方程式中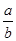 =________。
=________。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为_________。

(3)下列叙述中能说明上述反应达到平衡状态的是________。
A 反应中M与N的物质的量之比为1:1
B 混合气体的总质量不随时间的变化而变化
C 混合气体的总物质的量不随时间的变化而变化
D 单位时间内每消耗a mol N,同时生成b mol M
E.混合气体的压强不随时间的变化而变化
F.N的质量分数在混合气体中保持不变
参考答案:(6分,每空2分)(1)2;(2)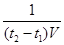 ?mol·L-1·min-1;(3)CEF(对2个给1分,有错不给分)
?mol·L-1·min-1;(3)CEF(对2个给1分,有错不给分)
本题解析:
试题分析(1)从图像可知,从开始到平衡,△n(N)=8mol-2mol=6mol,△n(M)=5mol-2mol=3mol,故此反应的化学方程式中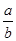 =
=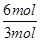 =2。
=2。
(2)t1到t2时刻,以M的浓度变化表示的平均反应速率为v(M)= ?mol·L-1·min-1。
?mol·L-1·min-1。
(3)A.反应中M与N的物质的量之比为1:1,是反应过程的一种状态,不能确定是否达到平衡;B.无论反应进程如何,混合气体的总质量不会变化,故B不能判断;C.若反应还在正向进行,混合气体的总物质的量减小,若总物质的量不随时间的变化而变化,则达到平衡;D.单位时间内每消耗a mol N,为正速率,同时生成b mol M,为正速率,都是正速率,不能判断;E.混合气体的总物质的量减小,混合气体的压强减小,若混合气体的压强不随时间的变化而变化,则说明已经达到平衡;F.若反应还在正向进行,N的质量分数减少,若其在混合气体中保持不变,则说明已经达到平衡。
本题难度:一般
2、选择题 2007年度诺贝尔化学奖,授予致力于研究合成氨与催化剂表面积大小关系的德国科学家格哈德?埃特尔,表彰他在“固体表面化学过程”研究中作出的贡献。下列说法中正确的是
A.工业生产中,合成氨采用压强越高,温度越低,越有利于提高经济效益。
B.增大催化剂的表面积,能加快合成氨的正反应速率、降低逆反应速率
C.采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快
D.增大催化剂的表面积,能增大氨气的产率
参考答案:C
本题解析:A、温度太低反应速率太慢,不利于提高经济效益,A不正确;B、催化剂能同等程度改变正逆反应速率,B不正确;C、催化剂能改变活化能,所以采用催化剂时,反应的活化能降低,使反应易达过渡态,故明显加快,C正确;D、催化剂只能改变反应速率,不能改变平衡状态,D不正确,答案选C。
本题难度:一般
3、填空题 某温度时在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
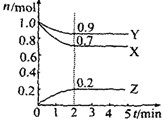
(1)该反应的化学方程式为:
(2)反应开始至2min,用X表示的平均反应速率为:
(3)下列叙述能说明上述反应达到化学平衡状态的是 (填字母)
A.混合气体的总物质的量不随时间的变化而变化
B.单位时间内每消耗3mol X,同时生成2mol Z
C.混合气体的总质量不随时间的变化而变化
(4)在密闭容器里,通入a mol X(g)和b mol Y(g),发生反应X(g)+ Y(g)=2Z(g),当改变下列条件时,反应速率会发生什么变化(选填“增大”、“ 减小” 或“不变”)
① 降低温度:
②保持容器的体积不变,增加X(g)的物质的量:
③ 增大容器的体积:
参考答案:(1)3X+Y 2Z(不写可逆符号不给分)
2Z(不写可逆符号不给分)
(2)0.075mol?L-1?min-1
(3)A
(4)①减小②增大③减小
本题解析:(1)由图可知,X、Y是反应物,物质的量分别减少0.3mol、0.1mol,Z是生成物,物质的量增加0.2mol,则方程式中X、Y、Z的物质的量比是3:1:2,所以该反应的化学方程式为:3X+Y 2Z
2Z
(2)X的浓度减少0.3mol/2L="0.15mol/L," 所以反应开始至2min,用X表示的平均反应速率为0.15mol/L/2min=0.075mol?L-1?min-1
(3)A、该反应是气体的物质的量减小的反应,当达到化学平衡时,混合气体的总物质的量不随时间的变化而变化,正确;B、反应在任何时刻都有单位时间内每消耗3mol X,同时生成2mol Z,不能判定是否达化学平衡状态,错误;C、任何化学反应都遵循质量守恒定律,错误,答案选A。
(4)根据条件对反应速率的影响,①降低温度,反应速率减小;②增大反应物的浓度,反应速率增大;③增大容器的体积相当于减小压强,反应速率减小。
考点:考查化学方程式的推导,反应速率的计算,化学平衡状态的判断,条件对反应速率的影响
本题难度:一般
4、选择题 相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g) 2XY3(g) △H="-92.6" kJ.mol-1
2XY3(g) △H="-92.6" kJ.mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器
编号
| 起始时各物质物质的量/mol
| 达到平衡的时间
| 达平衡时体系能量的变化
|
X2
| Y2
| XY3
|
①
| 1
| 3
| 0
| 2分钟
| 放热46.3kJ
|
②
| 0.4
| 1.2
| 1.2
| /
| Q(Q>0)
|
下列叙述不正确的是
A.容器①中反应从开始到刚达平衡时用XY3表示的反应速率为v(XY3)="1/30" moI.L-l·s-1
B.平衡时,两个容器中XY3的物质的量浓度相等
C.容器②中反应达到平衡时吸收的热量为Q
D.容器①体积为0.3L,则达平衡时放出的热量大于46.3kJ
参考答案:D
本题解析:生成2molXY3时放出92.6kJ的热量,容器①中达到平衡时放出46.3kJ,说明有1.0mol XY3生成,所以用XY3表示的反应速率为v(XY3)="1.0mol/0.25L/120s=1/30" moI.L-l·s-1,A对。容器②中XY3的物质的量完全转化为X2、Y2时分别是0.6mol、1.8mol,加上原有的0.4mol、1.2mol,所以X2、Y2的起始物质的量相当于是1mol、3mol,与容器①中完全相同,所以二者达到的平衡是等效平衡,XY3的物质的量浓度相等,B对。容器②中反应达到平衡时的热效应是Q>0,所以反应吸热,C对。若增大容器的体积,则压强减小,平衡逆向移动,所以容器①达到平衡时放出的热量小于46.3kJ,D错
本题难度:一般
5、选择题 下列说法正确的是
A.常温下,中和pH与体积均相同的盐酸和醋酸消耗NaOH的物质的量相同
B.纯铁和生铁在酸雨中均发生电化学腐蚀
C.使用催化剂不但能加快反应速率,而且可以让不可能发生的反应发生
D.食品工业用NaHCO3作焙制糕点的膨松剂
参考答案:D
本题解析:A、醋酸是弱酸,部分电离,pH相同的盐酸与醋酸中是醋酸浓度远大于盐酸,体积相同时消耗NaOH是醋酸远大于盐酸,错误;B、纯铁只含铁不能构成原电池,发生化学腐蚀,生铁中碳与铁构成原电池,发生电化学腐蚀,错误;C、催化剂只能降低活化能,从而改变反应速率,不能改变反应热能,更不能使不能发生的反应发生,错误;D、NaHCO3受热或能与酸反应产生CO2,能使食物蓬松,正确。3的用途。
本题难度:一般