1、实验题 在化学分析中,为了测定某试样中FeSO4·7H2O的质量分数,一般采用在酸性条件下用高锰酸钾标准溶液滴定的方法,反应原理为:5Fe2++8H++MnO4- 5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+
5Fe3++Mn2++4H2O。高锰酸钾标准溶液可用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]进行标定,反应原理为:5C2O42-+2MnO4-+16H+ 10CO2↑+2Mn2++8H2O。
10CO2↑+2Mn2++8H2O。
实验步骤如下:
步骤一:先粗配浓度约为1.5×10-2mol·L-1的高锰酸钾溶液500 mL。
步骤二:称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用(1)所配高锰酸钾溶液进行滴定,从而可标定高锰酸钾溶液的浓度。经测定,c(KMnO4)=0.0160 mol·L-1
步骤三:称取FeSO4·7H2O试样1.073g,放入锥形瓶中,加入适量的水溶解,
步骤四:用标准高锰酸钾溶液滴定步骤三所配样品溶液,达到终点时消耗标准溶液48.00mL。
试回答下列问题:
(1)步骤一中要用到的玻璃仪器是烧杯、___________?、?。
(2)步骤二中需要对m的大致值进行预估,你预估的依据是?
___________________________________________________?。
(3)本实验中操作滴定管的以下图示,正确的是______________(填编号)。

(4)步骤二的滴定是在一定温度下进行的,操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是?______________________?。
(5)请在下面空白处设计步骤四中的数据记录和数据处理表格(不必填数据)。
(6)国家标准规定FeSO4·7H2O的含量(w):一级品100.5%≥w≥99.50%;二级品? 100.5%≥w ≥99.00%;三级品? 101.0%≥w≥98.00%。试判断该试样符合国家________级品标准。
(7)测定试样中FeSO4·7H2O的含量时,有时测定值会超过100%,其原因可能是?
_______________________________________________?。
参考答案:(1)量筒、玻璃棒(少答或多答“容量瓶”不给分)(2分)
(2)根据反应的定量关系、滴定管的规格(最大容量)及KMnO4溶液的粗浓度来确定(一般比计算值低一些)(2分)(或根据KMnO4的用量及反应的反应的定量关系)
⑶ A (2分)
⑷生成的Mn2+为催化剂,使反应速率变大(2分)
⑸(2~3次实验,酌情给分)(2分)
平行实验编号
Na2C2O4质量
(m)
滴定管起始读数
(mL)
滴定管滴定终点读数
(mL)
消耗KMnO4溶液体积
(mL)
1
?
?
?
?
2
?
?
?
?
3
?
?
?
?
?⑹一(99.50%)(2分)
⑺FeSO4·7H2O会风化,失去部分结晶水(2分)
本题解析:(1)由于是粗配,不需要用容量瓶,只要用烧杯,量筒这些粗量器即可.
(2)该步要求由根据KMnO4的用量及反应的反应的定量关系来算Na2C2O4固体用量,现在KMnO4溶液浓度已知,需要知道它的体积,而体积的最大值就是滴定管的最大容量.
(3)酸性KMnO4溶液必须用酸式滴定管盛装滴定.
(4)反应速度骤然增大往往是由于催化剂\或升温\或加压(对气体参与的反应有效),该题所涉及的反应物产物为非气体,而且是在一定温度下进行的,所以最有可能是催化剂所致
(5)见上图
(6)FeSO4与KMnO4反应时分别生成Fe3+和Mn2+,根据得失电子守恒可知5 FeSO4~KMnO4,
n(KMnO4)= 0.01600*0.04800="0.0007680mol" , n(FeSO4·7H2O)="0.003840mol" , m(FeSO4·7H2O)=278*0.003840="1.068g" ,FeSO4·7H2O的含量为1.068/1.073*100%=99.53%,符合一级品要求。
(7)FeSO4·7H2O会风化,失去部分结晶水。
本题难度:一般
2、选择题 下列说法正确的是( )
A.Fe与过量稀H2SO4反应可以生成Fe2(SO4)3
B.Cu与FeCl3溶液反应可以说明Cu比Fe活泼
C.FeCl2不能通过化合反应得到
D.证明FeCl2溶液中含有FeCl3可以用KSCN溶液证明
参考答案:D
本题解析:Fe与过量稀H2SO4反应只能生成硫酸亚铁,A不正确;B不正确,该反应不能说明,且铁的金属性就是比铜强;C不正确,例如铁和氯化铁反应生成氯化亚铁,因此答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,主要是考查学生对铁及其化合物性质和铁离子检验的熟悉掌握程度,有利于培养学生灵活运用基础知识解决实际问题的能力,也有利于培养学生的应试能力和学习效率。
本题难度:简单
3、计算题 在铁和氧化铁的混合物15g中,加入稀硫酸150mL,标准状况下放出1.68LH2,同时铁和氧化铁均无剩余;向溶液中滴入KSCN溶液未见颜色变化。为了中和过量的硫酸,且使Fe2+完全转化成Fe(OH)2,共耗去了3mol·L-1的NaOH溶液200mL。求原硫酸溶液的物质的量浓度。
参考答案:2mol·L-1
本题解析:本题的反应式很多,有Fe2O3与H2SO4反应,生成的Fe2(SO4)3又与Fe反应,Fe与H2SO4反应;加入的NaOH与H2SO4、FeSO4反应等。但最终产物是Na2SO4和Fe(OH)2。根据守恒原理:
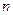 (SO
(SO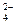 )=
)=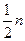 (Na+),
(Na+),
亦即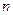 (H2SO4)=
(H2SO4)=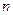 (NaOH)=
(NaOH)=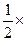 0.6mol=0.3mol。
0.6mol=0.3mol。
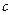 (H2SO4)=
(H2SO4)=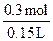 =2mol·L-l。
=2mol·L-l。
本题难度:简单
4、选择题 用铜锌合金制成假元宝欺骗行人事件屡有发生。下列不易区别其真伪的方法是
A.测定密度
B.放入硝酸中
C.放入盐酸中
D.观察外观
参考答案:D
本题解析:不同的物质具有不同的密度所以可以根据密度来区分铜锌合金和假元宝,A可以鉴别;铜锌合金中的铜和锌都可以与硝酸反应,产生气泡,若果是金元宝则不能反应,没有气泡产生,B可以鉴别;铜锌合金中的锌可以与盐酸反应产生气泡,C可以鉴别,铜锌合金是黄色的,金也是黄色,所以通过观察外观是不能鉴别的,答案选D。
本题难度:一般
5、实验题 [2012·石家庄质检](12分)某研究性学习小组为探究Cu(OH)2受热分解产物及产物性质,设计如下实验。
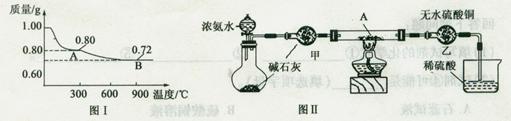
(1)取0.98 g Cu(OH)2固体加热,质量随温度变化的曲线如图1所示,产物A、B的化学式分别为?和?。
(2)取少量产物B加入足量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在,该反应的离子方程式为?。
(3)为证明产物A在加热时能与NH3反应,某同学设计了如图Ⅱ(夹持装置未画出)所示实验装置。
①简述检查该装置气密性的方法?。
②实验过程中观察到两个明显现象:
i直玻璃管中固体由黑色变为红色;ii装置乙中固体由白色变为蓝色。
能证明产物A与NH3发生了反应的判断依据的是?(填选项字母)。
a.只有i可以? b.只有ii可以? c.i或ii都可以
参考答案:(12分)(1)CuO? Cu2O
(2)Cu2O+2H+=Cu2++Cu+H2O
(3)如图连接装置,关闭分液漏斗旋塞,将末端导管浸入水中;用热毛巾捂住烧瓶底部,若导管口有气泡连续冒出,撤掉热毛巾,冷却至室温后导管内形成一段液柱且持续不落,则证明装置气密性良好? b
本题解析:(1)很明显A是CuO,n(CuO) =0.80g/80g·mol-1=0.01mol,由A到B失去氧的物质的量为:(0.80g-0.72g)/16 g·mol-1=0.005mol,0.72gB中含有0.01molCu和0.005molO,Cu和O的物质的量之比为2:1,所以B的化学式为Cu2O。
(2)该反应生成了Cu2+和Cu,故该反应的离子方程式为Cu2O+2H+=Cu2++Cu+H2O。
(3)②由图1知CuO受热分解生成红色的Cu2O,所以现象i不能说明CuO加热时能与NH3反应;现象ii说明有水生成,从而说明加热时CuO能与NH3反应,故b正确。
本题难度:一般