|
高考化学知识点总结《铁的氧化物》试题预测(2019年最新版)(八)
2019-05-30 03:51:14
【 大 中 小】
|
1、选择题 下列反应中,铁只能生成高价化合物的是
A.过量的铁与稀HNO3反应
B.铁粉与硫蒸气反应
C.铁粉与氯气反应
D.红热的铁粉与水蒸气反应
参考答案:C
本题解析:略
本题难度:简单
2、选择题
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。?在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________?另一电极所发生的电极反应为_____________________________?方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
参考答案:①方案1:Fe3+>Cu2+>H+>Fe2+?漏斗、烧杯、玻璃棒方案2:阴? 2Fe3++2e-=2Fe2+;? Cu2++2e-="Cu" ;2H++2e-=H2↑;? 2Cl--2e-=Cl2↑有污染性气体Cl2产生?②使用了电解装置,成本较高等。
本题解析:本题以废液中回收Cu为素材,将氧化还原反应知识和电化学知识紧密的结合起来,方案1中同时考查了过滤操作。方案2是用电解的方法回收Cu,用铜和石墨作电极,铜要做阴极,阳离子在阴极得电子,因溶液中含有Fe3+、Cu2+、H+、Fe2+,所以存在得电子顺序问题,由方案1中知氧化性由强到弱的顺序为Fe3+>Cu2+>H+>Fe2+,故得电子顺序为Fe3+>Cu2+>H+>Fe2+,由题意知Fe3+、Cu2+、H+分别先后在阴极得电子。最后一问还从环保和经济方面考查了方案的不足。
本题难度:一般
3、填空题 某氧化铁样品中含有少量的FeSO4杂质。某同学要测定其中铁元素的质量分数,他设计了如下方案进行测定,操作流程为:
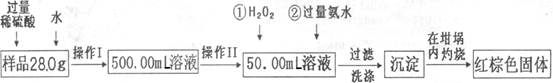
请根据流程回答:
(1)操作I中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有??(填仪器名称)。
(2)操作II中必须用到的仪器是?。
A.50mL量筒
B.100mL量筒
C.50mL酸式滴定管
D.50mL碱式滴定管
| (3)反应①中,加入足量H2O2溶液反应的离子方程式?。
(4)检验沉淀中SO42-是否冼涤干净的操作?
?。
(5)将沉淀物加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为blg,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,还应进行的操作是?
?。
(6)若坩埚的质量为42.6g,最终坩埚与加热后同体的总质量为44.8g,则样品中铁元素的质量分数=?(保留一位小数)。
(7)另一同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水后充分搅拌,加热蒸干灼烧称量即可,请你评价他的这个方案是否可行??。(填“可行”或“不可行”)
参考答案:(16分)(1)500mL容量瓶(2分)?(2)C(2分)
(3)2Fe2++H2O2+2H+=2Fe3++2H2O(3分)
(4)取少量最后一次洗涤液于试管中,加入Ba(NO3)2(或BaCl2)溶液,若无白色沉淀,则沉淀洗净(2分)
(5)继续加热,冷却至室温、称量,直至两次连续称量质量差不0.1g(2分)
(6)55.0%(3分)?(7)不可行(2分)
本题解析:(1)根据配制一定物质的量浓度溶液的方法可知,配制500.00mL溶液先后需要烧杯、量筒、玻璃棒、500mL容量瓶、胶头滴管等仪器;(2)量筒的精确度一般为0.1mL,滴定管的精确度一般为0.01mL,Fe2O3+3H2SO4(过量)=Fe2(SO4)3+3H2O,硫酸铁、硫酸亚铁和硫酸的混合溶液显酸性,量取50.00mL酸性溶液应该选择50mL酸式滴定管,故只有C正确;(3)双氧水是常用绿色氧化剂,其目的是将硫酸亚铁氧化为硫酸铁,根据化合价升降总数、电荷总数、原子个数守恒可知:2Fe2++H2O2+2H+=2Fe3++2H2O;(4)H++NH3?H2O= H2O +NH4+、Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+,Fe(OH)3沉淀表面吸附着可溶性的硫酸铵、氨水,由于SO42―+Ba2+=BaSO4↓,因此常用可溶性钡盐溶液检验SO42―是否洗涤干净;(5)2Fe(OH)3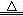 Fe2O3+3H2O,若b1、b2几乎相等,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1—b2=0.3,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;(6)先求氧化铁的质量,m(Fe2O3)=44.8g—42.6g=2.2g;再求铁元素的质量,Fe2O3=2Fe+3O,则m(Fe)= m(Fe2O3)×112/160=(44.8g—42.6g)×112/160;根据铁元素质量守恒可知,50.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160,则500.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;最后求样品中铁元素的质量分数,w(Fe)=" m(Fe)/" m(样品)×100%=(44.8g—42.6g)×112/160×500.00mL/50.00mL÷28.0g×100%=55.0%;(7)样品中Fe2O3难溶于水,FeSO4易溶于水,加热能促进FeSO4水解生成Fe(OH)2、H2SO4,Fe(OH)2易被氧化为Fe(OH)3,H2SO4难挥发,Fe(OH)3与H2SO4易发生中和反应生成Fe2(SO4)3、H2O,蒸干灼烧不能使Fe2(SO4)3溶液分解为Fe2O3,故该方案不可行。 Fe2O3+3H2O,若b1、b2几乎相等,说明Fe(OH)3沉淀几乎完全分解为Fe2O3固体,若b1—b2=0.3,说明Fe(OH)3沉淀没有彻底分解,因此需要对盛有Fe(OH)3沉淀的坩埚进行多次加热、在干燥器中冷却、称量并记录质量,直至称量质量几乎相等;(6)先求氧化铁的质量,m(Fe2O3)=44.8g—42.6g=2.2g;再求铁元素的质量,Fe2O3=2Fe+3O,则m(Fe)= m(Fe2O3)×112/160=(44.8g—42.6g)×112/160;根据铁元素质量守恒可知,50.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160,则500.00mL待测液中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;根据铁元素质量守恒可知,28.0g样品中m(Fe)=(44.8g—42.6g)×112/160×500.00mL/50.00mL;最后求样品中铁元素的质量分数,w(Fe)=" m(Fe)/" m(样品)×100%=(44.8g—42.6g)×112/160×500.00mL/50.00mL÷28.0g×100%=55.0%;(7)样品中Fe2O3难溶于水,FeSO4易溶于水,加热能促进FeSO4水解生成Fe(OH)2、H2SO4,Fe(OH)2易被氧化为Fe(OH)3,H2SO4难挥发,Fe(OH)3与H2SO4易发生中和反应生成Fe2(SO4)3、H2O,蒸干灼烧不能使Fe2(SO4)3溶液分解为Fe2O3,故该方案不可行。
本题难度:困难
4、简答题 (15 分)废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧电池的铜帽(Cu、Zn 总含量约为99%)回收Cu并制备ZnO 的部分实验过程如下:
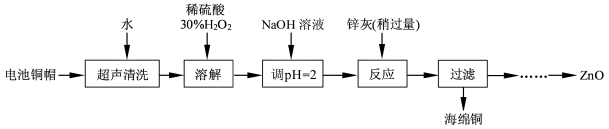
(1)①铜帽溶解时加入H2O2的目的是?(用化学方程式表示)。②铜帽溶解完全后, 需将溶液中过量的H2O2除去。除去H2O2的简便方法是?。
(2)为确定加入锌灰(主要成分为Zn、ZnO,杂质为铁及其氧化物)的量,实验中需测定除去H2O2后溶液中Cu2+的含量。实验操作为:准确量取一定体积的含有Cu2+的溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI,用Na2S2O3标准溶液滴定至终点。上述过程中反应的离子方程式如下:摇摇2Cu2++4I-=2CuI(白色)↓+I2? 2S2O32- +I2=2I-+S4O62-
①滴定选用的指示剂为?,滴定终点观察到的现象为?。
②若滴定前溶液中的H2O2没有除尽,所测定的Cu2+含量将会?(填“偏高”、“偏低”或“不变”)。
(3)已知pH>11 时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1. 0 mol·L-1计算)。
?
| 开始沉淀的pH
| 沉淀完全的pH
| Fe3+
| 1. 1
| 3. 2
| Fe2+
| 5. 8
| 8. 8
| Zn2+
| 5. 9
| 8. 9
|
实验中可选用的试剂:30%H2O2、1. 0 mol·L-1HNO3、1. 0 mol·L-1NaOH。由除去铜的滤液制备ZnO 的实验步骤依次为:①?;②?;③过滤;④?;⑤过滤、洗涤、干燥;⑥900℃煅烧。
参考答案:(1)①Cu+H2O2+H2SO4=CuSO4+2H2O?②加热(至沸)
(2)①淀粉溶液?蓝色褪去?②偏高
(3)①向滤液中加入适量30% H2O2,使其充分反应
②滴加1.0 mol·L-1NaOH,调节溶液pH 约为5(或3.2≤pH<5.9),使Fe3+沉淀完全
④滤液中滴加1. 0 mol·L-1NaOH,调节溶液pH 约为10(或8. 9≤pH≤11),使Zn2+沉淀完全
本题解析:(1)目标反应可由已知的两个反应相加得到,反应热也有对应法则求得;该反应类似于复分解或盐的水解,但生成的气体是甲烷;
(2)稀有气体如果不是反应物,一般作保护区,防止金属被氧化;氢气的计算可理解为原储氢材料中存储的氢全部放出,另外金属材料再与酸反应也生成氢气,则可计算出生成52molH2。由于Al的衍射强度较低,即铝参与了反应,所以铝是主要产生氢气的物质。
(3)铝是负极是材料,参与负极反应,铝失去电子并与介质中氢氧根离子反应生成偏铝酸根离子,正极氧化银得到电子生成银。
【考点定位】废电池中铜的回收、ZnO的制备实验
本题难度:一般
5、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
参考答案:(1) 过滤? (2)SiO2或二氧化硅? Fe203或氧化铁 (3 [Al(OH)4]-或A102-? (4)Fe3++3OH-==Fe(OH)3↓
本题解析:(1)过滤适用于不溶性固体和液体之间的一种分离方法,所以分离溶液和沉淀的操作名称是过滤。
(2)氢氧化铁受热分解生成氧化铁,所以B是氧化铁。
(3)二氧化硅和盐酸不反应,氧化铁、氧化铝和反应,所以沉淀A是二氧化硅。X中含有氯化铁、氯化铝和过量的盐酸。由于氢氧化铝能溶于氢氧化钠溶液中,所以滤液Y中还含有偏铝酸钠。
(4)氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,反应的离子方程式是Fe3++3OH-==Fe(OH)3↓
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
本题难度:一般
|