1、选择题 下列元素属于卤族元素的是(?)
A.F? B.P?C? He? D.Li
参考答案:A
本题解析:卤素元素的最外层电子数是7个,所以氟是卤素,P是第ⅤA,He是稀有气体,Li是碱金属,答案选A。
本题难度:简单
2、填空题 (8分)等质量的D2O和H2O所含的中子数之比为________,电子数之比为_________;等物质的量的D2O和H2O分别与足量的金属钠反应,放出的氢气的质量比为__________,转移电子数之比为__________。
参考答案:9:8? 9:10? 2:1? 1:1
本题解析:D2O和H2O所含有的中子数分别是10和8,电子数分别都是10,所以在质量相等的
情况下中子数之比为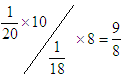 ,电子数之比是
,电子数之比是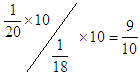 。等物质的
。等物质的
量的D2O和H2O分别与足量的金属钠反应,放出的氢气的体积是相同的,所以质量之比是4︰2=2︰1,而转移的电子数之比则是1︰1。
本题难度:一般
3、选择题 下列说法正确的是( )。
A.氢原子光谱是元素的所有光谱中最复杂的光谱之一
B.“量子化”就是不连续的意思,微观粒子运动均有此特点
C.玻尔理论不但成功解释了氢原子光谱,而且还推广到其他原子光谱
D.原子中电子在具有确定半径的圆周轨道上像火车一样高速运转着
参考答案:B
本题解析:氢原子光谱是元素的所有光谱中最简单的光谱;原子光谱源自核外电子在能量不同的轨道之间的跃迁,而电子所处的轨道的能量是“量子化”的,其他微粒如分子、离子等无此特点;玻尔理论成功地解释了氢原子光谱,但对多电子原子的光谱却难以解释;原子中电子没有确定的半径,原子半径是电子运动的“区域”。
本题难度:简单
4、填空题 (18分)下表是元素周期表的一部分,回答下列有关问题:(用元素符号或化学式填空)
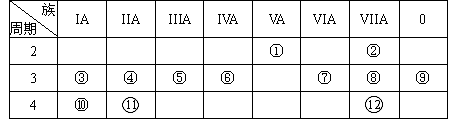
(1)写出下列元素符号:①________,⑥________,⑦________。
(2)画出原子的结构示意图:④________,⑤________,⑧________。
(3)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是________,最不活泼的元素是________。
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________,呈两性的氢氧化物是________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明:答:________
在⑧与⑿中,化学性质较活泼的是________,怎样用化学实验证明?答:____________。(用化学反应方程式表示)
参考答案:(1)①N;⑥Si;⑦S;(2) ;
;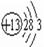 ;
;
(3)K;F;Ar?(4)HClO4;KOH;Al(OH)3;
(5)Na;与H2O反应;? Cl2;Cl2+2NaBr=2NaCl+Br2
本题解析:考查元素周期表的结构和元素周期律的应用。根据元素在周期表中的位置可判断①~?分别为N、F、Na、Mg、Al、Si、S、Cl、Ar、K、Ca、Br。根据元素周期律可知同周期自左向右非金属性逐渐增强,金属性逐渐减弱。同主族自上而下金属性逐渐增强,非金属性逐渐减弱。所以①~?金属性最强的是K,非金属性最强的是F。稀有气体的最外层电子已经达到稳定结构,所以性质最不活泼。金属性越强,最高价氧化物的水化物的碱性越强。非金属性越强,最高价氧化物的水化物的酸性越强。所以酸性最强的是HClO4,碱性最强的是KOH,两性的是Al(OH)3。比较元素的金属性强弱可以利用金属单质和水或酸反应的剧烈程度,或者是相互之间的置换能力等。比较元素的非金属性强弱,也可以利用单质之间的相互置换能力,或者与氢气化合的难易程度以及相应氢化物的稳定性等。
本题难度:一般
5、填空题 (15分)有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色。试回答:
(1)元素符号:X________,Y_________,Z__________。
(2)Y的两种氧化物为____________和___________。
写出此两种氧化物与水反应的化学方程式_____________;____________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为___________________。
(4)写出Y和Z形成的化合物的电子式:___________;Z单质分子的电子式:__________
参考答案:(1) I?、Na、? Cl(每空1分)
(2) Na2O、? Na2O2?(每空1分)
Na2O+H2O=2NaOH(2分)? 2Na2O2+2H2O = 4NaOH+O2↑(2分)
(3)Cl2+2I—=2Cl— + I2?(2分)
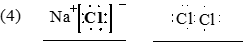 (每空2分)
(每空2分)
本题解析:Y的两种氧化物为:Na2O、Na2O2,则Y是Na;由“Z和X的原子最外层电子数相等”,得:Z和X同主族;由“淡黄绿色的Z单质的水溶液”,得:Z是Cl,Cl2+2KI=2KCl + I2 ;
本题难度:一般