1、选择题 化学与生产、生活、社会密切相关.下列表述正确的是
A.焰火与高中化学中“焰色反应”的知识相关,焰色反应是化学变化
B.2CH3CH2OD+O22CH3CHO+2DHO
C.二氧化硫、氨、煤的液化均属于物理变化
D.在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质会变性
参考答案:B
本题解析:分析:A、焰色反应是元素的性质属于物理变化;
B、依据醇的催化氧化历程分析判断产物;
C、煤的液化是化学变化;
D、蛋白质语带重金属盐变性,轻金属盐发生盐析.
解答:A、焰色反应是金属元素的性质变化过程中无锌物质生成,属于物理变化,故A错误
B、醇的催化氧化是羟基氢和连羟基的碳原子上的氢原子断键生成醛,化学方程式符合反应原理,故B正确;
C、煤的液化是化学变化,故C错误;
D、在鸡蛋白溶液中加入浓Na2SO4溶液,蛋白质会盐析,属于物理变化,故D错误;
故选B.
点评:本题考查焰色反应的实质,醇的催化氧化反应原理分析,蛋白质变性的条件,注意煤的气化、液化属于化学变化,题目较简单.
本题难度:一般
2、填空题 (15分)有A、B、C、D四种化合物,分别由Ba2+、K+、SO42-、OH-、CO32-、SO32-?中的两种所组成,它们各具有下列性质:①A既不溶于水,又不溶于盐酸,②B不溶于水,但可溶于盐酸并放出无色无味气体;③C的水溶液呈碱性,与稀硫酸反应生成A④D溶于水,与硫酸作用时放出的气体E可使溴水褪色。
(1)推断A、B、C、 D、E各为何种物质,写出它们的化学式。(5分)
D、E各为何种物质,写出它们的化学式。(5分)
A:?,B:?,C:?,D:?,E:?。
(2)写出下列离子方程式:(4分)
B与盐酸反应?;
C与硫酸反应?;
D与硫酸反应?;
E与溴水反应?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 下列各组离子,可能大量共存于无色溶液中的是
A.Na+、H+、CO32-、NO3-
B.Fe2+、Mg2+、Cu2+、Cl-
C.Ba2+、Cl-、NO3-、OH-
D.Mg2+、OH-、HCO3-、Cl-
参考答案:C
本题解析:试题分析:A.Na+、H+、CO32-、NO3- 中H+、CO32-不共存;
B.Fe2+、Mg2+、Cu2+、Cl- 中铜离子有颜色;? D.Mg2+、OH-、HCO3-、Cl-?中Mg2+、OH-不共存,故选C。
考点:离子共存
点评:离子共存的规律是:观颜色,查酸碱,能反应(复分解反应和氧化还原反应等),不共存。
本题难度:简单
4、填空题 某强酸性溶液X可能含有Ba2+、A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-、NO3-中的一种或几种,取该溶液进行连续实验,实验过程如下:
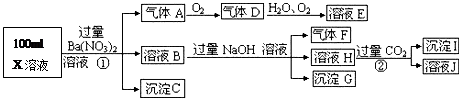
根据以上信息,回答下列问题:
(1)气体F为?
(2)上述离子中,溶液X中除H+外还肯定含有的离子是?,不能确定是否含有的离子是?.
(3)写出生成A的离子方程式:?
(4)通常可以利用KClO在碱性条件下氧化G来制备一种新型、高效、多功能水处理剂K2FeO4.请写出制备过程中的离子方程式?.
(5)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,且不能确定的离子只有一种。当X溶液中不能确定的离子是?,则沉淀C的物质的量为?
参考答案:(1)NH3?(1分)
(2)Al3+、NH4+、Fe2+、SO42-;?(1分)? Fe3+、Cl-?(1分)
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O?(2分)
(4)3ClO—+2Fe(OH)3+4OH—=3Cl—+2FeO42—+5H2O?(2分)
(5)Fe3+,?(1分)?大于0.7mol (1分)或Cl-?小于 0.7mol
本题解析:在强酸性溶液中一定不会存在CO32-和SO32-离子,加入过量硝酸钡生成沉淀,则该沉淀为BaSO4沉淀,说明溶液中含有SO42-离子,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,一定为Fe2+离子,溶液B中加入过量NaOH溶液,生成气体F,则F为NH3,说明溶液中含有NH4+离子,溶液H中通入过量的CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,溶液中含有Fe2+离子,就一定不含NO3-离子,含有SO42-离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl-,故答案为:(1)气体F为NH3;(2)Al3+、NH4+、Fe2+、SO42-;Fe3+、Cl-;(3)Fe2+离子被氧化为Fe3+离子,同时生成NO,反应的离子方程式为3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
(4)根据题意反应方程式为:3ClO—+2Fe(OH)3+4OH—=3Cl—+2FeO42—+5H2O
(4)A、F、I均为0.01mol,10mL?X溶液中n(H+)=0.04mol,根据反应3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,可知Fe2+离子为0.03mol,根据溶液电中性可知:2n(Fe2+)+3n(Al3+)+n(NH4+)=2n(SO42-),
n(SO42-)=  ?=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离 子,故答案为:大于0.07mol,Fe3+(或者小于0.07mol,Cl-)
?=0.07mol,当沉淀C物质的量>0.07mol时一定含有Fe3+离子,反之,含有Cl-离 子,故答案为:大于0.07mol,Fe3+(或者小于0.07mol,Cl-)
本题难度:困难
5、选择题 一种化学冰袋中含有Na2SO4·10H2O(96 g)、NH4NO3(50 g)、(NH4)2SO4(40 g)、NaHSO4(40 g).将Na2SO4·10H2O和其他3种盐分盛于2只塑料袋中,用时使它们混合并用手搓揉就可制冷,制冷效果能维持2~3h.以下关于其制冷原因的猜测肯定错误的是
A.Na2SO4·10H2O脱水是吸热过程
B.较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程
C.铵盐在该条件下发生复分解反应是吸热反应
D.NH4NO3溶于结晶水中会吸收热量
参考答案:C
本题解析:化学冰袋能够制冷的原因应该是在揉搓制冷的过程中发生了吸热反应或吸热变化,Na2SO4·10H2O在揉搓的过程中脱水,NH4NO3溶于结晶水中会吸收热量,较长时间制冷是由于Na2SO4·10H2O脱水是较慢的过程,因此,A、B、D正确.Na2SO4·10H2O、NH4NO3、(NH4)2SO4、NaHSO4之间不会发生复分解反应,所以C错误.
本题难度:简单