1、实验题 (8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验步骤
| 实验结论
|
①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
| 氧化性从强到弱的顺序:氯、溴、碘
|
②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
|
③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
|
请回答:
(1)完成该实验需用到的实验仪器是?。
(2)CCl4在实验中所起的作用是?。
(3)该同学的实验设计不足之处是?,
改进的办法是?。
2、计算题 (1)下列四种粒子中,半径按由大到小的排列顺序是 。
①基态X的原子结构示意图:○+16
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:
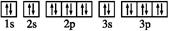
④W基态原子有2个能层,电子式:∶∶
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 ,离子半径由大到小的顺序是 ,原子序数由大到小的顺序是 。
3、选择题 如果发现了原子序数为116的元素,对它的描述正确的是(? )
①位于第7周期?②是非金属元素?③最外电子层含有6个电子?④没有放射性?⑤属于氧族元素?⑥属于卤素
A.①③⑤
B.①③⑥
C.②④⑥
D.②③⑤
4、选择题 与NH4+互为等电子体的分子是:(?)
A.CH4
B.OH-
C.NH3
D.H3O+
5、填空题 (2009·安徽理综)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___?(填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+ (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+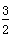 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是_________________________________________。