1、实验题 (8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验步骤
| 实验结论
|
①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
| 氧化性从强到弱的顺序:氯、溴、碘
|
②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
|
③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色
|
请回答:
(1)完成该实验需用到的实验仪器是?。
(2)CCl4在实验中所起的作用是?。
(3)该同学的实验设计不足之处是?,
改进的办法是?。
参考答案:(每空2分)
(1)试管?胶头滴管? (2)萃取剂
(3)没有比较Br2和I2的氧化性强弱;把第③步改为:将溴水滴在淀粉KI试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色)
本题解析:(1)该实验在溶液中反应,反应物都是液体,反应物用量较少属于验证性试验,且不需要加热,所以用到的实验仪器只是试管和胶头滴管。
(2)实验中是根据反应后溴单质和碘单质的颜色来判断是否发生反应,溴单质和碘单质易溶于CCl4,CCl4在此的作用就是萃取溴和碘的单质,有利于颜色的观察,所以CCl4的作用是萃取剂。
(3)实验②验证氯和溴的强弱,实验③验证了氯和碘的强弱,该实验中没有验证溴和碘的强弱,所以是不能得出结论的;改进是方法可以是:把第③步改为溴单质与KI溶液反应具体操作为:将溴水滴在淀粉KI试纸上,观察试纸是否变蓝色(或KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色)。
本题难度:一般
2、计算题 (1)下列四种粒子中,半径按由大到小的排列顺序是 。
①基态X的原子结构示意图:○+16
②基态Y的价电子排布式:3s23p5
③基态Z2-的电子排布图:
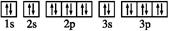
④W基态原子有2个能层,电子式:∶∶
(2)已知An+、B(n+1)+、Cn-、D(n+1)-都具有相同的电子层结构,则A、B、C、D的原子半径由大到小的顺序是 ,离子半径由大到小的顺序是 ,原子序数由大到小的顺序是 。
参考答案:(1)③>①>②>④
(2)A>B>D>C D>C>A>B B>A>C>D
本题解析:(1)①X是S原子,②Y是Cl原子,③Z2-是S2-,④W是C原子,根据半径的比较规律,所以半径的大小顺序是③>①>②>④
(2)根据“阴上阳下”的原则,C、D在上一周期,A、B在下一周期;D所带负电荷多,说明D在C的左侧,B带的正电荷多,说明B在A的右侧,A、B、C、D的相对位置如图:
?
?
?
D
C
?
A
B
?
?
?
?
?
所以原子半径的大小关系是A>B>D>C;离子的电子层结构相同,核电荷数越多,半径越小,所以离子半径的顺序是D>C>A>B;原子序数的大小顺序是B>A>C>D。
本题难度:一般
3、选择题 如果发现了原子序数为116的元素,对它的描述正确的是(? )
①位于第7周期?②是非金属元素?③最外电子层含有6个电子?④没有放射性?⑤属于氧族元素?⑥属于卤素
A.①③⑤
B.①③⑥
C.②④⑥
D.②③⑤
参考答案:A
本题解析:116号元素位于第7周期ⅥA族,属于氧族元素,为金属元素,具有放射性。
本题难度:简单
4、选择题 与NH4+互为等电子体的分子是:(?)
A.CH4
B.OH-
C.NH3
D.H3O+
参考答案:A
本题解析:电子数和原子数分别都相等的是等电子体。所以答案选A。
本题难度:一般
5、填空题 (2009·安徽理综)W、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子,Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物。
(1)W位于元素周期表第_____周期第______族。W的气态氢化物稳定性比H2O(g)_____(填“强”或“弱”)。
(2)Y基态原子核外电子排布式是________,Y第一电离能比X的___?(填“大”或“小)
(3)Y的最高价氧化物对应水化物的浓溶液与Z的单质反应的化学方程式是________________________________________________________________________。
(4)已知下列数据:Fe(s)+ (g)===FeO(s) ΔH=-272.0 kJ·mol-1
(g)===FeO(s) ΔH=-272.0 kJ·mol-1
2X(s)+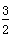 O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
O2(g)===X2O3(s) ΔH=-1 675.7 kJ·mol-1
X的单质和FeO反应的热化学方程式是_________________________________________。
参考答案:(11分)(1)二 ⅤA 弱 ? (2)1s22s22p63s23p4 大
(3)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(4)3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s) ΔH=-859.7 kJ·mol-1
本题解析:W、Y的氧化物是导致酸雨的主要物质,则W是N元素,Y是S元素。X的基态原子核外有7个原子轨道填充了电子,且原子序数小于S的,所以X是Al元素。Z能形成红色(或砖红色)的Z2O和黑色的ZO两种氧化物,则Z是Cu。
(1)氮元素位于第二周期第ⅤA族。氮元素的非金属性弱于氧元素的,所以氨气的稳定性小于H2O的。
(2)根据构造原理可知,S元素基态原子的核外电子排布式是1s22s22p63s23p4。非金属性越强,第一电离能越大,则S元素的第一电离能大于Al元素的第一电离能。
(3)Y的最高价氧化物对应水化物的浓溶液是浓硫酸,所以与Cu的单质反应的化学方程式是Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(4)根据盖斯定律可知,①×3-②即得到3FeO(s)+2Al(s)===Al2O3(s)+3Fe(s),所以该反应的反应热ΔH=-272.0 kJ·mol-1×3+1 675.7 kJ·mol-1=-859.7 kJ·mol-1。
点评:该题是中等难度的试题,也是该中的常见考点和题型。试题综合性强,难易适中,侧重对学生能力的培养和解题方法与技巧的指导和训练。该题主要是以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般