|
|
|
高中化学知识点归纳《原电池原理》考点巩固(2019年最新版)(六)
2019-05-30 04:03:34
【 大 中 小】
|
1、选择题 如图是一电池,下列有关说法正确的是
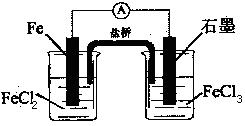
A.该电池负极反应为:2Fe2+-2e-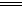 2Fe3+ 2Fe3+
B.当有6.02×1023电子转移时,Fe电极减少56g
C.石墨电极上发生氧化反应
D.盐桥中K+移向FeCl3溶液
参考答案:D
本题解析:该原电池中,铁作负极,石墨作正极,A.负极上铁失电子发生氧化反应,电极反应式为:Fe-2e-═Fe2+,A错误;B.当有6.02×1023电子转移时,Fe电极减少的质量=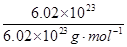 × ×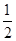 ×56g·mol-1=28g,B错误;C.石墨作正极,正极上铁离子得电子发生还原反应,C错误;D.盐桥中K+移向正极电解质溶液,即移向FeCl3溶液,D正确;选D. ×56g·mol-1=28g,B错误;C.石墨作正极,正极上铁离子得电子发生还原反应,C错误;D.盐桥中K+移向正极电解质溶液,即移向FeCl3溶液,D正确;选D.
本题难度:一般
2、填空题 甲醇是一种常用的燃料,工业上可以用CO和H2在一定条件下合成甲醇。
(1)已知CO(g)、H2(g)、CH3OH(1)的燃烧热△H分别为:-283.0kJ/mol、-285.8 kJ/mol、-726.5kJ/mol,则CO合成甲醇的热化学方程式为: 。
(2)在恒容密闭容器中CO与H2发生反应生成甲醇,各物质浓度在不同条件下的变化状况如图所示(开始时氢气的浓度曲线和8分钟后甲醇的浓度曲线未画出。4分钟和8分钟改变的条件不同):

①下列说法正确的是
A.起始时n(H2)为1.7mol
B.当容器内压强恒定时,说明反应达到平衡状态
C.4分钟时,改变的条件是升高温度
D.7分钟时,v(CO)=v(CH3OH)
| ②计算0~2min内平均反应速率v(H2)=
③在3min时该反应的平衡常数K= (计算结果)
④在图中画出8~12min之间c(CH3OH)曲线
(2)2009年,中国在甲醇燃料电池技术上获得突破,组装了自呼吸电池及主动式电堆,其装置原理如图甲。
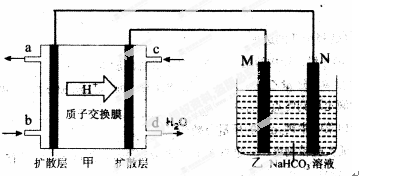
①该电池的负极反应式为: 。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。
M电极的材料是 ,该铝制品表面“钝化”时的反应式为: 。
参考答案:化学反应式或方程式未配平的均扣1分
(1)CO(g)+2H2(g)=CH3OH(l) △H=-128.1kJ/mol (2分,方程式1分,反应热2分,状态错误扣1分,计量数错误不得分。)
(2) ① BD (2分,少选扣1分,有错选不得分)
② 0.4mol/(L·min) 或6.67×10-3 mol·L-1·s-1(2分,无单位不得分)
③ 0.99 (2分,数值在1.0~0.98之间均得分,写成“ ”或“ ”或“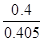 ” 得1分,单位不做要求。) ” 得1分,单位不做要求。)
④
(3)① CH3OH-6e-+H2O=CO2↑+6 H+ (2分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
② 铝制品(1分,写“Al”或“铝”均可,其他书写不得分)
2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O(3分,或“Al-3e-=Al3+,Al3++3HCO3-=Al(OH)3↓+3CO2↑,2Al(OH)3=Al2O3+3H2O”各1分,无“↑”或计量数不是最简不扣分;其他书写不得分。)
本题解析:(1)先写出三种物质的燃烧热的热化学方程式。
① CO(g) △H1=-283.0kJ/mol △H1=-283.0kJ/mol
② H2(g)+ 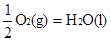 △H2=-285.8 kJ/mol △H2=-285.8 kJ/mol
③ CH3OH(1)+ 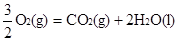 △H3=-726.5kJ/mol △H3=-726.5kJ/mol
再写出目标方程式:CO(g)+2H2(g)=CH3OH(l) △H4
根据盖斯定律, ①+②×2-③即得到目标方程式。 △H4= △H1+△H2×2-△H3=-128.1kJ/mol
根据图像: CO(g)+2H2(g)=CH3OH(l)
起始:(mol/L) 0.9 x 0
0-2min(mol/L) —0.4 —0.8 0.4
2-4min(mol/L)(平衡) 0.5 0.9 0.4
4-6min(mol/L) —0.2 —0.4 0.2
6-8min(mol/L)(平衡) 0.3 0.5 0.6
8-10min(mol/L) —0.1 —0.2 0.1
10-12min(mol/L)(平衡)0.2 0.3 y
①A项,起始时浓度x=C(H2)为1.7mol/L,容器体积未知,所以物质的量也未知,A项错误。
B项,该容器是一个恒容的容器,反应是一个非等体积反应,因此当气体的总物质的量不再改变,即压强不再改变,反应即达到平衡状态,正确。
C项,4min时,平衡向右移,并且各物质的浓度是逐渐变化,所以应该是降温的条件下,C项错误。
D项,7min时,反应再次达到平衡,此时v(CO)=v(CH3OH),D项正确。
②0~2min内平均反应速率v(H2)=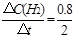 ="0.4" mol·L-1·min-1 ="0.4" mol·L-1·min-1
③在3min时该反应的平衡常数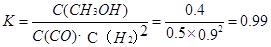
④在第8min时,CO的浓度减少0.1mol·L-1,H2的浓度减少0.2mol·L-1,可知平衡在向右移动,CO和H2的浓度都是逐渐变小,而此时的条件和上次平衡移动的条件不相同,所以只能是减少甲醇的浓度,才能使平衡向右移动,即在平衡移动的瞬间,甲醇的浓度是很少的,应该要低于0.05mol·L-1,然后再增加0.1mol·L-1,在第10min平衡,并且浓度y不超过0.15mol·L-1。
(3)该装置中甲是一个燃料电池装置,给右边的装置乙提供电能,乙装置是一个电解池装置。
①甲中质子移向右边,从而推知甲装置左是负极,右是正极,则乙装置中M是阳极,N是阴极。甲中电池的负极反应式为:CH3OH-6e-+H2O=CO2↑+6 H+ 要注意电解质溶液质子在进行传递。
②乙池是一铝制品表面“钝化”装置,两极分别为铝制品和石墨。则阳极M材料是铝制品,阴极N材料是石墨。在铝表面钝化,即把铝变成Al2O3,同时考虑溶液中溶质为NaHCO3,则电极反应为:2Al-6e-+6HCO3-=Al2O3+6CO2↑+3H2O
考点: 考查热化学方程式的书写、化学平衡原理及其图像问题、电化学综合。
本题难度:困难
3、选择题 下列叙述正确的是 ( )
①原电池是把化学能转化成电能的一种装置 ②原电池的正极发生氧化反应,负极发生还原反应 ③不能自发进行的氧化还原反应,通过原电池的装置均可实现 ④碳棒不能用来作原电池的正极 ⑤反应Cu+2Ag+=2Ag+Cu2+,能以原电池的形式来实现
A.①⑤
B.①④⑤
C.②③④
D.②⑤
参考答案:A
本题解析:②原电池负极发生氧化反应;③不能实现;④碳棒可以作原电池的正极。
本题难度:一般
4、选择题 下列叙述正确的是
A.合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率
B.含1 mol Ba(OH)2的稀溶液和含1 mol H2SO4的稀溶液反应释放热量akJ,则表示该反应中和热的热化学反应方程式为:
OH-(aq)+H+(aq)=H2O(l) ?H =" -a" kJ·mol-1
C.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
D.对于2HI(g)  H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
参考答案:C
本题解析:A、合成氨生产过程中将NH3液化分离,不能加快正反应速率,错误;B、Ba(OH)2与H2SO4反应生成BaSO4沉淀和H2O,该反应的反应热不是中和热,错误;C、电解精炼铜,阳极除了Cu失电子,还有比铜活泼的锌、镍、铁失电子,正确;D、该反应气体的系数不变,增大平衡体系的压强,平衡不移动,与勒夏特列原理无关,错误。
本题难度:一般
5、填空题 (16分)
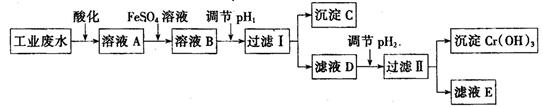
Ⅰ、工业上用含有Cr2O72-和CrO42-的废水回收铬。其工艺流程如下:
已知:①2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O; Cr2O72-(橙色)+ H2O;
②常温下,Ksp【Fe(OH)3】=1.0×10-38,Ksp【Cr(OH)3】=1.0×10-32;
③当离子浓度小于1.0×10-5mol·L-1时,认为沉淀完全。
(1)下列选项中能说明反应2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。 Cr2O72-(橙色)+ H2O达平衡状态的是_______(填选项字母)。
A.Cr2O72-和CrO42-的浓度相同
B.2v(Cr2O72-)= v(CrO42-)
C.溶液的颜色不变
D.溶液的PH不变
|
(2)为防止FeSO4溶液变质,在保存时需加入的试剂为
(填试剂名称)
(3)过滤操作中需要用到的玻璃仪器有
(4)FeSO4溶液与溶液A发生反应的离子方程式为
(5)沉淀C的化学式为
,pH2的范围为
Ⅱ、铝电池性能优越,铝一空气电池以其环保、安全而受到越来越多的关注,其原理如图所示。
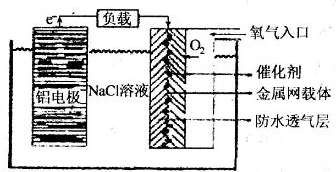
(6)该电池的总反应化学方程式为
;
(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则该过程中消耗铝的质量为
。
参考答案:(1)cd(各1分,共2分)
(2)铁粉 硫酸 (各1分,共2分)
(3)烧杯 漏斗 玻璃棒 (2分,只要有错不得分)
(4)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O (2分)
(5)Fe(OH)3 (2分) >5 (2分)
(6)4Al+3O2+6H2O=4Al(OH)3 (2分)
(7)2.7g (2分)
本题解析:
(1)2 CrO42-(黄色)+2H+  Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
B. 2v(Cr2O72-)= v(CrO42-),没体现出正反应速率等于逆反应速率,不能判断是否平衡,故B错误。C.溶液的颜色不变,说明物质的浓度不再变化,说明反应达平衡状态。故C正确。D.溶液的pH不变,说明H+浓度不变,化学反应达平衡状态。故D正确。(2)为防止FeSO4溶液变质,在保存时需加入的试剂为铁粉防止氧化,加入硫酸防止亚铁离子水解变浑。(3)过滤操作中需要用到的玻璃仪器有烧杯 漏斗 玻璃棒 。(4)已知工业废水中含有和CrO42-在酸化过程中CrO42-转化为Cr2O72-,所以加入的FeSO4溶液与Cr2O72-溶液发生反应的离子方程式为r2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。(5)已知常温下,Ksp【Fe(OH)3】=1.0×10-38<Ksp【Cr(OH)3】=1.0×10-32;调节pH1使Fe3+生成Fe(OH)3沉淀而析出,调节pH2目的是使Cr3+转化为Cr(OH)3而析出。由C(Cr3+)c3(OH-)=1×10-32,当Cr3+沉淀完全时
c3(OH-)=1×10-32/C(Cr3+)=1×10-32/1.0×10-5 =1×10-27
c(OH-)=1×10-9,pH=5,pH2的范围为pH2>5.
Ⅱ、(6)铝一空气电池的总反应化学方程式为4Al+3O2+6H2O=4Al(OH)3;(7)某铝一空气电池的效率为50%,若用其作电源电解500mL的饱和NaCl溶液,电解结束后,所得溶液(假设溶液电解前后体积不变)中NaOH的浓度为0.3 mol·L-1,则生成NaOH的物质的量为0.15 mol。由原电池反应方程式与电解总方程式可得关系式:
Al----3e----3NaOH
27g 3mol
m(Al)×50% 0.15mol
解得: m(Al)=2.7g
考点:了解化学平衡建立的过程。理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 了解难溶电解质的沉淀溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
点评:本题考查:化学平衡状态的判断依据:(1)速率判据:v正=v逆。(2)浓度判据:反应体系各物质的浓度(及与浓度相关的量如颜色、气体压强等)不再变化。熟练应用Ksp求算分离或除去某离子时的pH范围。电化学装置中的相关计算常采用电子守恒的方法。
本题难度:困难


 Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。
Cr2O72-(橙色)+ H2O达平衡状态时A.物质的平衡溶液与起始浓度与反应进行的程度有关,Cr2O72-和CrO42-的平衡浓度相同,不能判断是否达到平衡,故A错误。