| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点归纳《原电池原理》考点巩固(2019年最新版)(四)
参考答案:C 本题解析:试题分析:A.由Al、Cu、稀H2SO4组成原电池,Al为负极,放电时SO42-向Al电极移动,A正确。B.由Mg、Al、NaOH溶液组成原电池,Al为负极失电子氧化反应:Al-3e-+4OH-=AlO2-+2H2O,B正确。C.由Fe、Cu、NaCl溶液组成原电池,Fe为负极,负极反应式为:Fe-2e-=Fe 2+,C不正确。D.由Al、Cu、浓硝酸组成原电池中铝钝化作正极,铜作负极电极反应为Cu-2e-=Cu 2+;电解硝酸银溶液,当析出1 mol Ag时,电路中转移1 mol电子,消耗Cu 0.5mol为32g,D正确。 本题难度:一般 2、选择题 碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)下列说法错误的是 参考答案:B 本题解析: 本题难度:一般 3、选择题 铜锌原电池在工作时,下列叙述正确的是 |
参考答案:B
本题解析:A.不正确, Zn-2e-=Zn2+是负极反应;
B.正确,电池反应为:Zn+Cu2+=Zn2++Cu;
C.不正确,在外电路中,电流从正极流向负极;
D.不正确,盐桥中的K+移向CuSO4溶液;
选B。
本题难度:一般
4、选择题 甲醇燃料电池的电池反应为:2CH3OH+3O2+4OH? 2CO32?+6H2O,则下列说法不正确的是
2CO32?+6H2O,则下列说法不正确的是
A.充电时,电能转化为化学能
B.充电时,电解质溶液中c(OH?)逐渐增大
C.放电时,CH3OH参与反应的电极为负极,发生还原反应
D.放电时,负极的电极反应为:CH3OH—6e?+8OH?=CO32?+6H2O
参考答案:C
本题解析:A、充电时,发生电解反应,电能转化为化学能,正确;B、根据反应方程式,充电时生成OH?,所以电解质溶液中c(OH?)逐渐增大,正确;C、放电时,CH3OH参与反应的电极为负极,发生氧化反应,错误;D、放电时,负极上甲醇失电子,电极反应为:CH3OH—6e?+8OH?=CO32?+6H2O,正确。
考点:本题考查原电池和电解池原理。
本题难度:一般
5、选择题 对于锌、铜和稀硫酸组成的原电池(如下图),下列有关说法正确的是 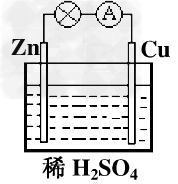
[? ]
①Zn是负极 ②电子由Zn经外电路流向Cu ③Zn?-2e-=Zn2+ ④H+在溶液中由Cu棒向Zn棒迁移
A.?①②?
B.?①②③?
C.?②③④?
D.?①②③④
参考答案:B
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《物质的分离.. | |