1、选择题 下列说法可以证明反应N2 + 3H2 2NH3,已达平衡状态的是( )
2NH3,已达平衡状态的是( )
A.1个N≡N键断裂的同时有6个H-N键形成
B.1个N≡N键断裂的同时有3个H-H键形成
C.容器内各物质的浓度相等
D.容器内N2、H2、NH3的速率之比为1:3:2
参考答案:B
本题解析:A中均表示υ(正),故错误;
B、υ(N2,正):υ(H2,逆)=1:3,故正确;
各组分浓度为定值,但不一定相等,故C错误;
要用速率判断是否达平衡状态,得能表明正、逆反应,而D中未指明,故错误;
本题难度:一般
2、选择题 已知可逆反应N2O4(g) 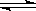 2NO2(g)?在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
2NO2(g)?在873K时,平衡常数K1=1.78×104,转化率为a%,在1273 K时,平衡常数K2 = 2.8×104,转化率为b%,则下列叙述正确的是
A.由于K2>K1,所以a>b
B.由于K随温度升高而增大,所以此反应的△H>0
C.由于K随温度升高而增大,所以此反应的△H<0
D.其它条件不变时,将盛有该混合气体的容器置于热水中,体系颜色变浅
参考答案:B
本题解析:A、由于1273K时的转化率大于873K时的转化率,说明温度越高,正向进行程度越大,所以正向反应是吸热反应,所以A错误;B选项由于K 随温度升高而增大,说明正向反应是吸热反应△H>0,所以B正确;C选项由于K 随温度升高而增大,说明正向反应是吸热反应△H>0,所以C错误;D选项由于温度不同,反应进行程度不同,因而转化率不同,反应机理是一样的,所以D错误;
点评:本题需熟练掌握化学平衡及转化率各物理量之间的关系,需要严密的逻辑推理能力,属于容易题。
本题难度:简单
3、选择题 对于气体反应mA(g)+nB(g)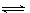 pC(g)+qD(g)△H?的下列4个图象中,图象及对应解读均正确的是(?)
pC(g)+qD(g)△H?的下列4个图象中,图象及对应解读均正确的是(?)

A.图①表示反应从正反应开始,m+n>p+q
B.图②表示反应从逆反应开始,△H>0
C.图③表示反应从逆反应开始,△H>0
D.图④表示反应从正反应开始,有无催化剂参与反应的比较
参考答案:B
本题解析:A:B%从零开始增大,说明反应是从逆反应开始,不正确
B:B%从零开始增大,说明反应是从逆反应开始;T1温度下先达到平衡,说明T1大于T2;升温时B%减小,则平衡正向移动,正反应为吸热反应,△H>0,正确
C:C%由大减小,说明平衡逆向移动,但并不能说明反应是从哪一方开始,排除
D:催化剂只能改变速率,但不能改变平衡及各物质的含量,不正确
答案为B
本题难度:一般
4、选择题 N2+3H2 2NH3反应达到平衡时的说法不正确的是( )。
2NH3反应达到平衡时的说法不正确的是( )。
A.平衡体系中氮气、氢气、氨的物质的量保持不变
B.平衡体系中氮气、氢气、氨的浓度保持不变
C.单位时间内生成的氨和分解的氨物质的量相同
D.单位时间内消耗的氮气和氢气与生成的氨气物质的量相同
参考答案:D
本题解析:达到平衡时,各组分的物质的量、浓度都会保持不变。无论是平衡状态时还是非平衡状态时,单位时间内消耗N2、H2的物质的量跟生成NH3的物质的量都不可能相等。
本题难度:简单
5、填空题 将1 mol I2(g) 和2 mol H2置于2L密闭容器中,在一定温度下发生反应:
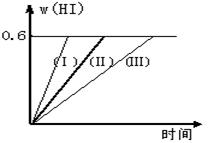
I2(g) + H2(g)  ?2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
?2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
(1)达平衡时,I2(g)的物质的量浓度为?写出该反应的平衡常数表达式? _____________________________________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ) 所示,在乙条件下w(HI)的变化如曲线(Ⅲ) 所示。则甲条件可能是?,则乙条件可能是??。
(填入下列条件的序号)
①恒容条件下,升高温度;? ②恒容条件下,降低温度;③恒温条件下,缩小反应容器体积;? ④恒温条件下,扩大反应容器体积;? ⑤恒温恒容条件下,加入适当催化剂。
参考答案:(1) 0.05mol/L;K=[HI]2/[H2][I2]?(2) 3、5;4
本题解析:(1)由于该反应前后气体体积不变,所以根据图像可知,平衡时HI的物质的量是3mol×0.6=1.8mol,则消耗单质碘的物质的量是0.9mol,所以平衡时I2(g)的物质的量浓度为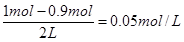 ;化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的化学方程式可知,该反应的平衡常数K=[HI]2/[H2][I2]。
;化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据反应的化学方程式可知,该反应的平衡常数K=[HI]2/[H2][I2]。
(2)曲线(Ⅰ)和曲线(Ⅱ)相比,HI的含量不变,即平衡状态不变,但到达平衡的时间减少。这说明反应速率加快,所以改变的条件应该是恒温条件下,缩小反应容器体积或恒温恒容条件下,加入适当催化剂,答案选③⑤;曲线(Ⅲ) 和曲线(Ⅱ)相比,HI的含量不变,即平衡状态不变,但到达平衡的时间增加。这说明反应速率降低,所以改变的条件应该是恒温条件下,扩大反应容器体积,答案选④。
点评:本题是高考中的常见题型,属于中等难度的试题,试题基础性强,难易适中。本题主要是检验学生对基础知识的理解掌握程度,以及图像识别、分析、归纳问题的能力,本题学生不难得分。
本题难度:困难