1、填空题 如图甲、乙是电化学实验装置。
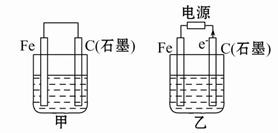
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为?;
②乙中总反应的离子方程式为?;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。若反应中Cl2和I2的物质的量之比为5∶1,且生成两种酸,该反应的化学方程式为:?;
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为:?;
②如果起始时乙中盛有200 mL pH = 5的CuSO4溶液(25 ℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入?(填写物质的化学式)?g。
参考答案:(1)①O2+2H2O+4e-=4OH-
②2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
③5Cl2+I2+6H2O=10HCl+2HIO3
(2)①Fe-2e-=Fe2+
②CuO(或CuCO3)? 0.8(或1.24)
本题解析:(1)若两烧杯中均盛有饱和NaCl溶液,则:
①甲装置为原电池,石墨棒作正极,O2放电,电极反应为:O2+2H2O+4e-=4OH-。
②乙装置为电解池,石墨棒上发生氧化反应,Fe电极不参与反应,其实质与用惰性电极电解食盐水相同,离子方程式为:2Cl-+2H2O Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
Cl2↑+H2↑+2OH-。③Cl2和I2的物质的量之比为5∶1,生成HCl和HIO3。
(2)若两烧杯中均盛有CuSO4溶液,则:①甲装置为原电池,铁作负极,电极反应式为:Fe-2e-=Fe2+。②乙装置为电解池,电解反应为:2CuSO4+2H2O 2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02×
2Cu+2H2SO4+O2↑,根据电解方程式,从电解质溶液中析出Cu,放出O2,因此只需加入CuO(或CuCO3)即可恢复到电解前的状态。由电解反应式可知,2H+~CuO~CuCO3,电解后n(H+)=" 0.1×0.2" = 0.02(mol),故m(CuO)=0.02× ×80 = 0.8(g),m(CuCO3)=0.02×
×80 = 0.8(g),m(CuCO3)=0.02× ×124=1.24(g)
×124=1.24(g)
本题难度:一般
2、选择题 用惰性电极电解500 mL CuSO4溶液,电解一段时间后,发现阴极增重0.064 g(假设电解时该电极无H2析出,且不考虑水解和溶液体积变化),此时溶液中c(H+)约为
A.4×10-3 mol·L-1
B.2×10-3 mol·L-1
C.1×10-4 mol·L-1
D.1×10-7 mol·L-1
参考答案:A
本题解析:总反应:2CuSO4+2H2O 2Cu+O2↑+2H2SO4,
2Cu+O2↑+2H2SO4,
电极反应:阴极 2Cu2+十4e—=2Cu?阳极 4OH——4e—=2H2O十O2↑;阴极析出铜0.001mol,阳极产生0.001mol H2SO4,0.002mol H+,c(H+)=4×10-3 mol·L-1。
本题难度:一般
3、实验题 在玻璃圆筒中盛有两种无色的互不相容的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:

(1)阳极上的电极反应式为?。
(2)阴极上的电极反应式为?。
(3)原上层液体是?。
(4)原下层液体是?。
(5)搅拌后两层液体颜色发生变化的原因是?。
(6)要检验上层液体中含有的金属离子?,现象是?。
参考答案:(1)2I-—2e-=I2 。(2)2H++2e?- = H2↑。(3)NaI或KI。(4)四氯化碳。(5)I2易溶于四氯化碳,难溶于水。(6)焰色反应。若焰色为亮黄色为NaI,通过蓝色钴玻璃观察,若焰色为紫色为KI。
本题解析:略
本题难度:一般
4、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
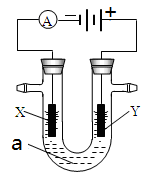
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
参考答案:(1) ① 2H++2e-=H2↑ ; 放出气体,溶液变红。
② 2Cl
本题解析:
本题难度:一般
5、选择题 通以相等的电量,分别电解等浓度的硝酸银和硝酸亚汞(亚汞的化合价为+1)溶液,若被还原的硝酸银和硝酸亚汞的物质的量之比n(硝酸银) ∶n(硝酸亚汞)=2∶1,则下列叙述正确的是
[? ]
A.在两个阴极上得到的银和汞的物质的量之比n(银) ∶n(汞)=2∶1
B.在两个阳极上得到的产物的物质的量不相等
C.硝酸亚汞的化学式为HgNO3
D.硝酸亚汞的化学式为Hg2(NO3)2
参考答案:D
本题解析:
本题难度:一般