1、选择题 目前,人们正在研究开发一种高能电池--钠硫电池,它是以熔融的钠和硫为两极,以Na+导电的β′-Al2O3
陶瓷作固体电解质,反应式如下:Na2Sx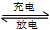 2Na+xS,以下说法正确的是
2Na+xS,以下说法正确的是
[? ]
A.放电时,Na作正极,S极发生还原反应
B.充电时,阳极发生的反应为:Sx2--2e-=xS
C.当用该电池电解AgNO3溶液时,阳极上产生标准状况下气体11.2L时,消耗金属钠23g
D.充电时钠极与外电源的正极相连
2、填空题 (17分)铁、铜及其化合物在工农业生产中应用广泛。
(1)在潮湿空气中,钢铁发生电化学腐蚀转化为Fe(OH)2的反应方程式为 。在含有等浓度硫酸溶液的下列装置中,铁腐蚀的速率由快到慢的顺序是 (用序号填写)。

(2)已知:①3Fe(s)+2O2(g)=Fe3O4(s)  H="-1118" kJ·mol-1
H="-1118" kJ·mol-1
②2Al(s)+3/2O2(g)=A12O3(s)  H="-1675.7" kJ·mol-1
H="-1675.7" kJ·mol-1
则焊接钢轨时铝与Fe3O4发生反应生成铁和Al2O3的热化学方程式为 。
(3)Na2FeO4具有强氧化性,其电解制法如图所示,请写出阳极的电极反应式 。Na2FeO4是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其原理是 。
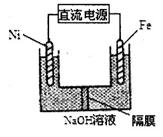
(4)工业上常用FeCl3溶液腐蚀印刷线路板,发生反应的离子方程式是 。若腐蚀铜板后的溶液中,Cu2+、Fe3+和Fe2+浓度均为0.1 mol·L-1,结合下图分析,当混合溶液中通入氨气调节溶液的pH=5.6时,溶液中存在的金属阳离子为 。从图中数据计算Fe(OH)2的溶度积Ksp[Fe(OH)2]= 。

已知:横坐标为溶液的pH,纵坐标为金属离子的物质的量浓度的对数(当溶液中金属离子浓度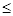 10-5 mol·L-1时,可认为沉淀完全)。
10-5 mol·L-1时,可认为沉淀完全)。
3、选择题 四个电解装置都以Pt做电极,它们分别装着如下电解质溶液进行电解,电解一段时间后,测定其pH变化,所记录的结果正确的是?
?
| A
| B
| C
| D
|
电解质溶液
| HCl
| AgNO3
| BaCl2
| KOH
|
pH值变化
| 减小
| 增大
| 不变
| 增大
4、选择题 电解原理在化学工业中有广泛应用。图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。下列说法不正确的是

[? ]
A.?若此装置用于电镀铜,则Y为铜电极,电解液a可以是硫酸铜或氯化铜溶液
B.?按图甲装置用惰性电极电解AgNO3溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量
C.?按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.1mol 的氧化铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为0.4mol
D.?若X、Y为铂电极,a溶液为250mL?CuSO4和KNO3的混合液,经过一段时间后,两极均得到标准状况下5.6L气体,则原混合液中CuSO4的物质的量浓度为1mol/L
5、选择题 如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是

[? ]
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-==4OH-
D.U型管中溶液pH逐渐减小
|