1、选择题 (10分)下图为实验室某浓盐酸试剂瓶上的标签,

试根据有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol/L。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.3 mol/L稀盐酸。
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中,需要使用的仪器是(填写代号)________。
A.烧杯 B.量筒 C.1000 mL容量瓶 D.托盘天平
E.药匙 F.500 mL容量瓶 G.胶头滴管 H.玻璃棒
③配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用蒸馏水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻度线1—2cm处
参考答案:21.(10分)(1)12mol·L-1;(2)BD ;(3)①12.5; ②ABFGH ; ③ BCAFED 。
本题解析:(1)浓盐酸中HCl的物质的量浓度为:c= =
=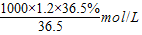 =12mol/L;
=12mol/L;
(2)取用任意体积的该盐酸溶液时,不同体积的溶液浓度相同,密度相同,答案为:B、D;
(3)①溶液稀释前后溶质的物质的量不变,设需浓盐酸的体积为V,则有12mol/L×V=0.5L×0.3mol/L,则V=0.0125L,及12.5ml,答案为:12.5;
②一般用量筒量取,在烧杯中稀释(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速稀释.冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2-3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀.所以所需仪器有量筒、烧杯、玻璃棒、500mL容量瓶、胶头滴管.答案为:ABFGH;
③操作步骤有计算、称量、溶解、移液、洗涤移液、定容、摇匀等操作,所以配制时,其正确的操作顺序是BCAFED,答案为:BCAFED。
考点:考查一定物质的量浓度溶液的配制。
本题难度:一般
2、计算题 某化合物的化学式可表示为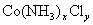 (x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用
(x、y为正整数)。为了确定x和y的值,取两份质量均为0.2140g的该化合物进行如下两个实验。将一份试样溶于水,在硝酸存在的条件下用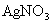 溶液滴定(生成
溶液滴定(生成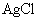 沉淀),共消耗24.0mL 0.100mol/L的
沉淀),共消耗24.0mL 0.100mol/L的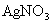 溶液。在另一份试样中加入过量
溶液。在另一份试样中加入过量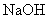 溶液并加热,用足量盐酸吸收逸出的
溶液并加热,用足量盐酸吸收逸出的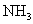 。吸收
。吸收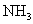 共消耗24.0mL 0.200mol/L
共消耗24.0mL 0.200mol/L 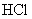 溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
溶液。试通过计算确定该化合物的化学式。(本题可能用到的相对原子质量:H为1.00、N为14.0、Cl为35.5、Co为58.9)
参考答案:解答:n表示物质的量,m表示质量
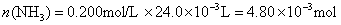
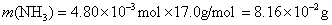
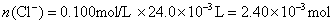




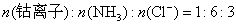
该化合物的化学式为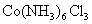 。
。
启示:同一习题,提倡一题多解,培养发散思维能力。如本题亦可有如下解法:
解法1:设0.2140g化合物的物质的量为n,根据关系式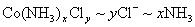 ,得方程:
,得方程:
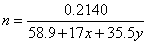 ①
①
 ②
②
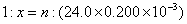 ③
③
联立①②③,解之得: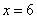 ,
,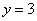 。
。
该化合物的化学式为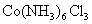 。
。
解法2:n表示物质的量,
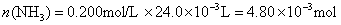
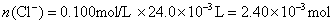
根据题意列方程组:
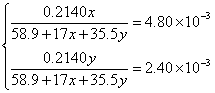 ?解方程组得:
?解方程组得: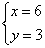
该化合物的化学式为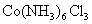 。
。
解法3:n表示物质的量。
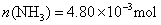
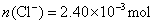
 ?即:
?即:
该化合物化学式可写成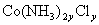 ,由题意得:
,由题意得:
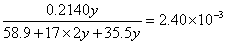 ?解之得:
?解之得: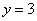
该化合物的化学式为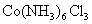 。
。
解法4:设0.2140g化合物的物质的量为c。

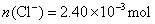
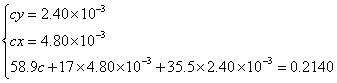
解联立方程得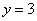 ,
,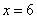 ,所以,其化学式为
,所以,其化学式为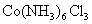 。
。

联立①、②解得: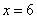 ,
,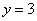 ,故化学式为
,故化学式为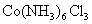 。
。
本题解析:此题有多种解法,训练学生的发散思维。
从消耗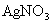 的物质的量可得化合物中
的物质的量可得化合物中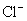 的物质的量;由吸收
的物质的量;由吸收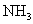 所消耗
所消耗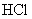 的物质的量可得
的物质的量可得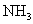 的物质的量,由试样质量减去
的物质的量,由试样质量减去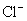 和
和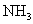 的质量可得钴离子的质量,除以钴的相对原子质量即得钴离子的物质的量。以钴离子的物质的量为1,即可确定x和y。
的质量可得钴离子的质量,除以钴的相对原子质量即得钴离子的物质的量。以钴离子的物质的量为1,即可确定x和y。
本题难度:简单
3、简答题 通常用氧化钾的质量分数来衡量肥料中钾肥的含量.某复合肥料由硝酸铵、磷酸氢二铵和氯化钾组成,已知该肥料中三种物质的质量比依次为1:2:2,则其中氧化钾的质量分数约为( )
A.6.31%
B.12.62%
C.25.23%
D.50.46%
参考答案:分别取1g硝酸铵、2g磷酸氢二铵、2g氯化钾,
根据K元素守恒,则K2O的质量为2g×3974.57894=9474.5g,
故氧化钾的质量分数约为9474.5g5g×100%=25.23%,
故选C.
本题解析:
本题难度:一般
4、选择题 取100mL0.3mol/L的H2SO4溶液和200mL 0.25mol/L的H2SO4溶液注入500mL容量瓶中,再加水至刻度线,所得溶液中H2SO4的物质的量浓度为
[? ]
A.0.265mol/L
B.0.525mol/L
C.0.16mol/L
D.0.42mol/L
参考答案:C
本题解析:
本题难度:简单
5、计算题 试计算
将标准状况下的HCl气体2.24L溶于水形成100mL溶液,得到的盐酸溶液。然后与0.5mol/L,100ml的AgNO3溶液混合,充分反应后过滤并干燥,得到白色沉淀。试计算
(1)所得盐酸溶液的物质的量浓度
(2)得到白色沉淀的质量
参考答案:(1)1mol/L (4分)(2)7.175g(5分)
本题解析:略
本题难度:一般