1、填空题 现有下列可逆反应:A(g)+B(g)  xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
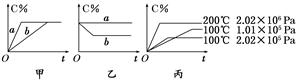
请根据图像回答下列问题:
(1)若甲图中两条曲线分别表示有催化剂和无催化剂的情况,则?曲线表示无催化剂时的情况(填字母,下同);
(2)若乙图表示反应达到平衡后分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入惰性(与反应体系中任一物质均不反应)气体后的情况,则?曲线表示恒温恒容的情况;
(3)根据丙图可以判断该可逆反应的正反应是?热反应(填“吸”或“放”);
(4)化学计量数x的值?(填取值范围);判断的依据是?。
参考答案:(1)b?(2)a?(3)吸
(4)大于2(或>2或≥3) 保持温度不变,增大压强,C%减小,说明平衡向逆反应方向移动,故x>1+1=2
本题解析:(2)恒温恒容下充入惰性气体,各组分浓度不变,平衡不移动,C%不变。
(3)保持压强不变,升高温度,C%增大,说明平衡向正反应方向移动,故正反应是吸热反应。
本题难度:一般
2、填空题 合成氨工业中,原料气(N2、H2及少量的CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(Ⅰ)溶液来吸收原料气中的CO,其反应是:[Cu(NH3)2CH3COO]+CO+NH3 [Cu(NH3)3]CH3COO·CO(正反应为放热反应)
[Cu(NH3)3]CH3COO·CO(正反应为放热反应)
(1)必须除去原料气中的CO的原因是?。
(2)醋酸二氨合铜(Ⅰ)溶液吸收CO的生产适宜条件是?。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用,醋酸铜氨溶液再生的适宜条件是?。
参考答案:(1)防止合成塔中的催化剂中毒
(2)低温、高压
(3)高温、低压
本题解析:吸收CO反应的正反应是气体减小的放热反应。故增压、降温都能使平衡正移,从而使CO被醋酸二氨合铜(Ⅰ)溶液吸收。反之可使平衡逆移。
本题难度:一般
3、选择题 一定温度下,将2mol A、2mol B、2mol C的气体混合物充入一体积不变密闭容器中,充分反应后恢复到起始温度,测得容器内的压强比起始时增大了20%,则容器中可能发生的反应是
A.2A+B 2C?B.A+B
2C?B.A+B 2C
2C
C.2A+B C?D.A+B
C?D.A+B 3C
3C
参考答案:D
本题解析:略
本题难度:一般
4、填空题 钢铁是21世纪用途最广的结构材料和功能材料。其成分主要是Fe和少量C。
(1)工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目?。
(2)铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图(黑球代表Fe,白球代表Mg)。则铁镁合金的化学式为?。

(3)Fe3+的电子排布式为?;CH3+微粒的中心原子杂化轨道类型为?;
(4)向一定量的FeCl3溶液中加入适量KSCN溶液,溶液变红色。该反应体系中存在化学平衡?(用反应式表示);向上述红色溶液中加入Mg(OH)2固体,可观察到溶液红色变浅,有红褐色沉淀析出。试用平衡移动原理解释该现象?。(不考虑SCN—与Mg2+反应)
参考答案:
(1)
(2)FeMg2 ?
(3)1S22S23S23P63d5?SP2
Fe2++3SCN- Fe(SCN-)3?(红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN-
Fe(SCN-)3?(红色) 由于氢氧化铁的溶解度小于氢氧化镁的溶解度,向上述体系中加入氢氧化镁后,发生沉淀转化:氢氧化镁沉淀转化成氢氧化铁沉淀,消耗了三价铁离子,使Fe2++3SCN- Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
Fe(SCN-)3 平衡向左移动,Fe(SCN-)3 减少。
本题解析:(1)根据元素守恒和质量守恒定律,不难写出相关化学方程式和画出单线桥;(2)利用均摊法,
Fe:8× +6×
+6× =4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数:
=4;Mg:8;得到铁镁合金化学式:FeMg2;(3)根据能量最低原理和核外电子排布原理,不难写出Fe3+,核外电子排布式;CH3+微粒的中心原子C,含有3δ,孤电子对数: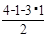 =0,
=0,
价层电子对数为4,杂化轨道类型SP2。(4)存在平衡Fe3++3SCN- Fe(SCN)3,根据勒夏特列原理不
Fe(SCN)3,根据勒夏特列原理不
难判断化学平衡的移动方向。
本题难度:一般
5、选择题 对于密闭容器中进行的反应:P(g)+ Q(g) R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是(? )
R(g)+ S(g)下列说法可以充分说明这一反应已经达到化学平衡状态的是(? )
A.P、Q、R、S的浓度相等
B.P、Q、R、S在密闭容器中共存
C.P、Q、R、S的浓度不再变化
D.用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等。
参考答案:C
本题解析:A.反应平衡时各物质的物质的量浓度相等有否与是否平衡无关,故A错误;B.反应为可逆反应,无论是否达到平衡状态,四种物质都共存,不能作为判断是否达到化学平衡的依据,故B错误;C.各物质的浓度不变,化学反应达到平衡状态,故C正确;D.反应速率之比等于化学计量数之比,用P的浓度表示的化学反应速率与用Q的浓度表示的化学反应速率相等,不能说明正逆反应速率相等,故D错误
本题难度:一般