1、选择题 按电负性值依次增大顺序排列的是
A.P S N
B.Li Na K
C.Li B Be
D.S P Si
参考答案:A
本题解析:非金属性越强,电负性越大,因此A正确。B不正确,应该是K、Na、Li;C不正确,应该是Li、Be、B;D不正确,应该是Si、P、S,答案选A。
点评:该题是基础性试题的考查,试题注重基础,兼顾能力的培养和训练。该题的关键是明确影响电负性大小的因素,然后结合同样灵活运用即可,难度不大,学生不难得分。
本题难度:简单
2、选择题 据科学家预测,月球的土壤中吸附着数百万吨的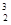 He,每百吨
He,每百吨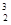 He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以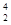 He的形式存在。下列说法正确的是( )。
He的形式存在。下列说法正确的是( )。
A.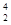 He原子核内含有4个质子
He原子核内含有4个质子
B.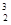 He和
He和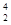 He互为同位素
He互为同位素
C.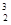 He原子核内含有3个中子
He原子核内含有3个中子
D.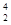 He的最外层电子数为2,所以
He的最外层电子数为2,所以 He具有较强的金属性
He具有较强的金属性
参考答案:B
本题解析:本题的解题关键在于熟悉原子的表示符号 X,A表示质量数,Z表示质子数,所以可判断A、C错误;又
X,A表示质量数,Z表示质子数,所以可判断A、C错误;又 He的最外层电子数为2,虽然少于8个,但属于稳定结构,因此D选项错误。
He的最外层电子数为2,虽然少于8个,但属于稳定结构,因此D选项错误。
本题难度:一般
3、选择题 X,Y是短周期元素,两者形成化合物X2Y3,若Y的原子序数为n,则X的原子序数不可能为?
A.n+8
B.n-3
C.n-11
D.n+5
参考答案:A
本题解析:在X2Y3中,X、Y的化合价分别为+3,-2价,则X为Ⅲ A,Y为ⅥA,X、Y的原子序数同周期差3。即X的原子序数可能有三种情况:①同周期为n-3;②上一周期为n-3-8=n-11;③下一周期为n-3+8=n+5,故A为正确答案。
本题难度:一般
4、选择题 发现电子的科学家是? (? )
A.汤姆生
B.卢瑟福
C.玻尔
D.道尔顿
参考答案:A
本题解析:A正确,汤姆生发现电子的科学家;B错,卢瑟福发现的原子结构不是一个实心的球体;C错,玻尔在卢瑟福的基础上进一步研究了原子结构;D错,道尔顿提出了原子的学说。
本题难度:简单
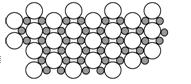
5、选择题 硼化镁在39 K时呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼的相间排列,右图是该晶体微观空间中取出的部分原子沿Z轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。确定硼化镁的化学式为 (? )
A.MgB
B.MgB2
C.Mg2B
D.MgB6
参考答案:B
本题解析:
每个白球周围有6个黑球,每个白球被6个小黑球所点有,同理每个小黑球被3个白球所点有,所以白球与黑球的原子个数比为1∶2 ,所以化学式为MgB2。
本题难度:简单