1、选择题 两种元素原子X和Y,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰为X原子的L层电子数的2倍。则X、Y分别是(?)
A.硅原子和钠原子
B.硼原子和氦原子
C.氯原子和碳原子
D.碳原子和铝原子
参考答案:D
本题解析:本题考查核外电子排布规律知识的运用。由于Y原子的M层比X原子的M层多3个电子,说明Y原子的M层的电子至少有3个,那么Y原子的L层必为8个电子,则X原子的L层有4个电子,M层无电子。由此推出Y原子的核外电子总数为13,X原子为6,即X、Y元素的核电荷数依次为6和13。
本题难度:简单
2、填空题 表是元素周期表的一部分。(注意:以下各空请用化学术语答题,不能用字母代替)
周期
| ⅠA
| ⅡA
| ⅢA
| ⅣA
| ⅤA
| ⅥA
| ⅦA
| O族
|
1
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| G
| H
| ?
| D
| ?
|
3
| B
| ?
| C
| ?
| ?
| ?
| E
| ?
|
4
| F
| A
| ?
| ?
| ?
| ?
| ?
| ?
|
(1)A~H八种元素中:
a.原子半径最小的元素对应的单质是?,还原性最强的单质是?。
b.最高价氧化物对应的水化物酸性最强的酸的化学式是?。
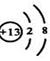
(2)C元素的离子结构示意图?,用电子式表示AD2的形成过程?。
(3)G元素的最高价氧化物的电子式?。
参考答案:(12分)(1)a.F2(2分)K(2分) ?b.HClO4(2分)
(2) (2分)
(2分)  (2分) (3)
(2分) (3)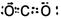 (2分)
(2分)
本题解析:(1)a.同主族自上而下,原子半径逐渐增大,金属性逐渐增强。同周期自左向右原子半径逐渐减小,金属性逐渐加热,所以原子半径最小的元素是F,则对应的单质是F2。还原性最强的单质是K。
b.非金属性越强,最高价氧化物的水化物的酸性越强,所以最高价氧化物对应的水化物酸性最强的酸的化学式是HClO4。
(2)C元素是Al,则其离子结构示意图为 ;A和D分别是Ca和F,因此用电子式表示AD2的形成过程是
;A和D分别是Ca和F,因此用电子式表示AD2的形成过程是 。
。
(3)G元素是碳元素,其最高价氧化物的电子式为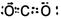 。
。
点评:该题是高考中的常见题型,试题综合性强,难易适中,贴近高考,有助于调动学生的学习兴趣和学习积极性。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
3、选择题 下列说法中错误的是(?)
A.元素周期表中有7个主族,7个副族
B.稀有气体元素原子的最外层电子数均为8
C.氢是原子半径最小的元素
D.氧元素位于第2周期ⅥA族
参考答案:B
本题解析:稀有气体元素He的最外层电子数是2个,B不正确,其余都是正确的,答案选B。
本题难度:一般
4、填空题 ( 7分 )同一周期的主族元素,从左到右,原子半径逐渐?,得电子能力逐渐______,非金属性逐渐______;同一主族元素,从上到下原子半径逐渐?,失电子能力逐渐______,单质的还原性逐渐______,氧化性逐渐______。
参考答案:减小;增强;增强;增大;增强;增强;减弱
本题解析:同一周期的主族元素,从左到右,原子半径逐渐减小,得电子能力逐渐__增强_,非金属性逐渐___增强___;同一主族元素,从上到下原子半径逐渐?增大?,失电子能力逐渐___增强___,单质的还原性逐渐__增强____,氧化性逐渐___减弱___。
本题难度:简单
5、选择题 某原子核内的质子数为m,中子数为n,则下述论断正确的是(?)
A.原子核内中子的总质量小于质子的总质量
B.该原子的质量数等于m-n
C.该元素的相对原子质量近似等于m+n
D.该原子的相对原子质量近似等于m+n
参考答案:D
本题解析:A选项,若为 则中子质量小于质子质量,若为
则中子质量小于质子质量,若为 则中子质量大于质子质量;B选项,质量数是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值。故该原子的质量数约等于m+n;C选项,相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。该元素的相对原子质量近似等于m+n;D选项,该原子的相对原子质量近似等于m+n,正确。
则中子质量大于质子质量;B选项,质量数是将原子内所有质子和中子的相对质量取近似整数值相加而得到的数值。故该原子的质量数约等于m+n;C选项,相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一种原子的平均原子质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。该元素的相对原子质量近似等于m+n;D选项,该原子的相对原子质量近似等于m+n,正确。
本题难度:一般