1、选择题 等物质的量的下列有机物完全燃烧,生成CO2的量最多的是
A.CH4
B.C2H6
C.C3H6
D.C6H6
参考答案:D
本题解析:试题分析:在物质的量消相等的条件下,有机物中碳原子数越多,完全燃烧生成的CO2就越多,则根据有机物的化学式可知,D选项中碳原子数最多,生成的CO2最多,答案选D。
考点:考查有机物的燃烧的有关计算
点评:该题是高考中额常见题型,属于中等难度的试题,试题基础性强,侧重对学生能力的培养和解题方法的指导与训练。该题的关键是利用好原子守恒,另外还要特别注意的是要分清楚是物质的量相等,还是质量相等,然后结合题意和有关方程式灵活运用即可。
本题难度:困难
2、选择题 氮化铝广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C? 2AlN+3CO合成.下列叙述正确的是
2AlN+3CO合成.下列叙述正确的是
A.Al2O3是氧化剂,C是还原剂
B.每生成1mol CO需转移2mol电子
C.AlN中氮元素的化合价为+3
D.AlN的摩尔质量为41g
参考答案:B
本题解析:分析:A.在氧化还原反应中,得电子化合价降低的反应物是氧化剂,失电子化合价升高的反应物是还原剂;
B.根据一氧化碳和转移电子之间的关系式计算;
C.在化合物中电负性大的显负价,电负性小的显正价;
D.摩尔质量的单位是g/mol.
解答:A.该反应中,氧化剂氮气,还原剂是碳,故A错误;
B.每生成1molCO需转移1(2-0)mol=2mol电子,故B正确;
C.氮化铝中氮元素的化合价是-3价,故C错误;
D.氮化铝的摩尔质量是41g/mol,故D错误;
故选B.
点评:本题考查氧化还原反应,明确元素化合价即可分析解答本题,难度不大.
本题难度:一般
3、选择题 下列物质与Fe反应后的生成物中,能与KSCN溶液作用生成红色物质的是
A.Cl2
B.盐酸
C.CuSO4溶液
D.醋酸
参考答案:A
本题解析:分析:物质与Fe反应后的生成物中,能与KSCN溶液作用生成红色物质,说明铁被氧化为三价铁,在溶液中遇到KSCN溶液作用生成红色物质;
解答:A、Cl2和铁反应生成氯化铁,在溶液中能与KSCN溶液作用生成红色物质,故A符合;
B、铁和盐酸反应生成氯化亚铁,在溶液中不能与KSCN溶液作用生成红色物质,故B不符合;
C、铁和硫酸铜反应生成硫酸亚铁和铜,在溶液中不能与KSCN溶液作用生成红色物质,故C不符合;
D、铁和醋酸反应生成醋酸亚铁和氢气,在溶液中不能与KSCN溶液作用生成红色物质,故D不符合;
故选A.
点评:本题考查了铁的化学性质应用,主要考查铁是变价金属,遇强氧化剂被氧化为三价铁,和弱氧化剂反应生成亚铁化合物,题目难度中等.
本题难度:简单
4、选择题 把m?molC2H4和n?molH2混合于密闭容器中,在适当条件下生成p?molC2H6.若将所得混合气体完全燃烧生成CO2和H2O,则需氧气
A.3.5pmol
B.(3m+0.5n)mol
C.(3m+n)mol
D.(3m+0.5n-3p)mol
参考答案:B
本题解析:分析:根据原子守恒可知,反应后混合气体的耗氧量即是m?molC2H4和n?molH2燃烧的耗氧量.反应物为CO2和H2O,根据C原子、H原子守恒可计算出最终消耗的氧气.
解答:反应前后C原子和H原子的物质的量没有发生变化,则混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,
原混合物中含有C原子的物质的量为2mmol,H原子的物质的量为(4m+2n)mol,
根据反应物为CO2和H2O可知,1molC原子消耗1mol氧气,1molH原子消耗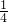 mol氧气,
mol氧气,
则消耗的氧气的物质的量为2mmol+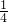 (4m+2n)mol=(3m+0.5n)mol,
(4m+2n)mol=(3m+0.5n)mol,
故选B.
点评:本题考查混合物的计算,题目难度不大,关键清楚反应后混合气体的耗氧量即是m?molC2H4和n?molH2燃烧的耗氧量.
本题难度:一般
5、选择题 化学反应SO2+H2O+HNO3-H2SO4+NO经配平后,还原剂的化学计量数为
A.1
B.2
C.3
D.4
参考答案:C
本题解析:分析:根据氧化还原反应得失电子数相等配平方程式.
解答:SO2+H2O+HNO3-H2SO4+NO,该反应中化合价的变化如下:SO2→H2SO4,S元素由+4价→+6价,一个SO2分子失2个电子,所以SO2是还原剂;HNO3→NO,N元素由+5价→+2价,一个HNO3分子得3个电子,所以硝酸是氧化剂;得失电子的最小公倍数为6,所以SO2的化学计量数为3,HNO3的化学计量数为2,其它元素根据原子守恒配平.所以该方程式为
3SO2+2H2O+2HNO3=3H2SO4+2NO.
故选C.
点评:本题考查了氧化还原反应方程式的配平,氧化剂、还原剂根据得失电子数相等配平,其它元素根据原子守恒配平.
本题难度:一般